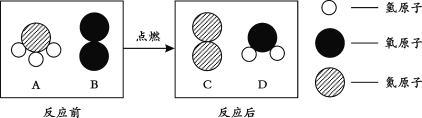
题目内容
【题目】(9分)随着社会的发展,人们对环境问题日益关注,同学们对煤进行了下列探究:
【提出问题】煤中是否含有碳元素和硫元素?
【查阅资料】①二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应化学方程式为: 5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2H2SO4
②二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应原理:
SO2 + Ca(OH)2 = CaSO3↓+ H2O。
【实验探究】
实验1:甲同学进行了如图所示A、B两步实验:
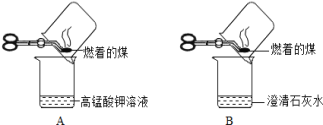
实验现象:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
甲得出结论:煤中含有碳元素和硫元素。
乙质疑甲同学的方案的合理性,其质疑的理由是____________________________________。
实验2:乙设计并进行了如图所示实验(夹持装置略去):
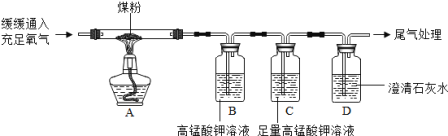
实验现象:①B中溶液褪色;②C中溶液变浅;③D中溶液变浑浊。
乙得出结论:煤中含有碳元素和硫元素。
【交流反思】(1)将煤磨成煤粉的目的是_________________________。
(2)实验中装置C的作用是________________________。
(3)D装置中发生反应的化学方程式为______________________。
(4)某工厂因生产需要每年要燃烧含硫0.8%的煤10000吨(假设煤中的硫为单质状态),利用方程式计算,若未经处理该工厂每年会向大气中排放的二氧化硫质量是多少?
【答案】【实验探究】 理由是:二氧化碳和二氧化硫都可使石灰水变浑浊,故根据甲的实验不能证明煤中一定含有碳元素。(意思正确即可)
【交流反思】(1)增大反应物的接触面积使反应更加充分,(2)除去SO2,防止干扰对CO2的检验
 (3)CO2 + Ca(OH)2 ==== CaCO3 ↓ + H2O(4)160吨
(3)CO2 + Ca(OH)2 ==== CaCO3 ↓ + H2O(4)160吨
【解析】
试题分析:二氧化碳和二氧化硫都可使石灰水变浑浊,故根据甲的实验不能证明煤中一定含有碳元素。将煤磨成煤粉的目的是增大反应物的接触面积使反应更加充分,实验中装置C的作用是让高锰酸钾和SO2反应,从而除去SO2,防止干扰对CO2的检验。D装置中发生反应是二氧化碳和氢氧化钙的反应。
解:设二氧化硫的质量为X,
S + O2 ===== SO2
![]() 32 64
32 64
0.8%×10000吨 X
![]()
![]()
X = 160吨

【题目】(7分)某同学在电视寻宝节目中,看到一些铜制文物上有绿色的锈迹,并对绿色锈迹产生了探究兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解。
②无水硫酸铜为白色粉末,遇水变蓝。
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水。
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体的成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告。
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O。
【进行实验】选择如下图所示装置进行验证。

步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二,关闭活塞,依次连接装置A→B→ → (填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和 H2O,写出C中反应的化学方程式 。
②Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
【题目】世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%,某实验小组对铁的燃烧和锈蚀进行如下探究。
探究一:铁丝燃烧
如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中。观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比Ⅰ中的更剧烈;Ⅲ中铁丝没有燃烧。
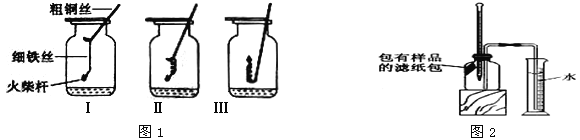
(1)集气瓶中加入少量水的作用: 。
(2)为什么Ⅲ中铁丝不能燃烧 。
(3)分析Ⅱ中铁丝燃烧比Ⅰ中更剧烈的原因 。
探究二:铁粉腐蚀的条件
如图2所示,将所有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进入广口瓶(容积为146 mL)。当温度恢复至室温,量筒内水面高度不变时读数(此时广口瓶内氧气含量几乎为零),记录量筒的起始和最终读数以及所需时间如下表:
序号 | 样 品 | 量筒起始读数/ mL | 量筒最终读数/ mL | 所需时间/ min |
① | 1.0g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
② | 1.0g铁粉、0.2g碳和10滴水和少量NaCl | 100 | 72 | 约70 |
③ |
(4)实验①和②说明NaCl可以 (填“加快”或“减慢”)铁锈蚀的过程。
(5)实验开始后,广口瓶温度上升,说明铁锈蚀是 (填“放热”或“吸热”)过程。
(6)实验①和③是探究碳对铁锈蚀速率的影响,实验③表格空白处样品的组成是 。
(7)该装置还可能用于测量空气中氧气的含量,根据上述数据计算得出空气中氧气的体积分数约是 %(精确到小数点后1位),试分析该实验结果出现误差的原因 。