题目内容
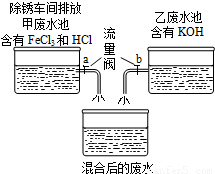
 课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图),课外小组的同学对混合后的废水池中的溶液进行探究.
课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图),课外小组的同学对混合后的废水池中的溶液进行探究.
【提出问题】混合后的废水中溶质的成分是什么?
【猜想假设】甲同学猜想:只含有KCl;乙同学猜想:含有KCl和HCl二种溶质
【表达与交流】甲同学猜想的理由是(1)______
【反思与评价】对乙同学的猜想进行评价(2)______
甲同学为了验证自己的猜想是正确的,取混合后的废水,过滤后向其中撤入Mg(OH)2粉末,无现象,请你对甲同学的实验设计做出评价(3)______
【解释与结论】根据除锈车间排放的废水成分知,除锈时发生的化学反应方程式为(4)______
【总结与应用】若混合后的废水中不含KOH且乙同学的假设是错误的,则混合后的废水中溶质是(5)______,为了使混合后的废水能浇灌农田,你应加大(6)______(填“a”或“b”)阀的流量,并测定混合液的pH=7.
解:(1)乙废水池中含有的可以和甲废水池中含有的FeCl3、HCl反应,只有KOH与FeCl3和HCl恰好反应时,溶质只含有KCl.故答案为:KOH与FeCl3和HCl恰好反应生成KCl.
(2)若溶液中HCl有剩余,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成 FeCl3.故答案为:若溶液中含有HCl,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成FeCl3.
(3)根据酸碱的性质可知,两种碱之间是不会发生反应的.所以向其中撤入Mg(OH)2粉末不与FeCl3及KOH反应.故答案为:撒入Mg(OH)2粉末不与FeCl3及KOH反应.
(4)盐酸和铁锈发生的反应是:Fe2O3+6HCl=2FeCl3+3H2O
(5)假如混合后的废水中不含KOH且乙同学的假设是错误的,则说明氢氧化钾的量不足,废水中溶质是KCl和剩余的FeCl3,所以应加大b阀的流量.故答案为:KCl和FeCl3、b.
故答案为:(1)KOH与FeCl3和HCl恰好反应生成KCl
(2)若溶液中含有HCl,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成FeCl3
(3)撒入Mg(OH)2粉末不与FeCl3及KOH反应
(4)Fe2O3+6HCl=2FeCl3+3H2
(5)KCl和FeCl3
(6)b
分析:乙废水池中含有的可以和甲废水池中含有的FeCl3、HCl反应,当KOH与FeCl3和HCl恰好反应时,只含有溶质KCl;若溶液中HCl有剩余,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成 FeCl3;根据酸碱的性质可知,两种碱之间是不会发生反应的;根据酸能和金属氧化物之间反应完成除锈时发生的化学反应方程式;假如混合后的废水中不含KOH且乙同学的假设是错误的,则说明氢氧化钾的量不足,废水中溶质是KCl和FeCl3,所以应加大b阀的流量.
点评:根据酸、碱、盐之间能否发生反应和物质的溶解性判断物质的在水中的存在状况,并结合题中三种物质的限定对甲、乙两车间废水中的物质进行判断.
(2)若溶液中HCl有剩余,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成 FeCl3.故答案为:若溶液中含有HCl,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成FeCl3.
(3)根据酸碱的性质可知,两种碱之间是不会发生反应的.所以向其中撤入Mg(OH)2粉末不与FeCl3及KOH反应.故答案为:撒入Mg(OH)2粉末不与FeCl3及KOH反应.
(4)盐酸和铁锈发生的反应是:Fe2O3+6HCl=2FeCl3+3H2O
(5)假如混合后的废水中不含KOH且乙同学的假设是错误的,则说明氢氧化钾的量不足,废水中溶质是KCl和剩余的FeCl3,所以应加大b阀的流量.故答案为:KCl和FeCl3、b.
故答案为:(1)KOH与FeCl3和HCl恰好反应生成KCl
(2)若溶液中含有HCl,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成FeCl3
(3)撒入Mg(OH)2粉末不与FeCl3及KOH反应
(4)Fe2O3+6HCl=2FeCl3+3H2
(5)KCl和FeCl3
(6)b
分析:乙废水池中含有的可以和甲废水池中含有的FeCl3、HCl反应,当KOH与FeCl3和HCl恰好反应时,只含有溶质KCl;若溶液中HCl有剩余,必含有FeCl3,因为在废水池中盐酸能与生成的Fe(OH)3反应生成 FeCl3;根据酸碱的性质可知,两种碱之间是不会发生反应的;根据酸能和金属氧化物之间反应完成除锈时发生的化学反应方程式;假如混合后的废水中不含KOH且乙同学的假设是错误的,则说明氢氧化钾的量不足,废水中溶质是KCl和FeCl3,所以应加大b阀的流量.
点评:根据酸、碱、盐之间能否发生反应和物质的溶解性判断物质的在水中的存在状况,并结合题中三种物质的限定对甲、乙两车间废水中的物质进行判断.

练习册系列答案
相关题目
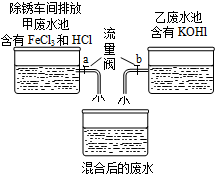
 24、课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图),课外小组的同学对混合后的废水池中的溶液进行探究.
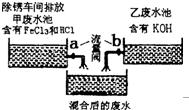
24、课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图),课外小组的同学对混合后的废水池中的溶液进行探究.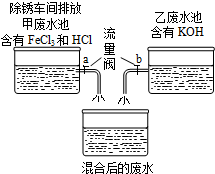 (2012?丹阳市二模)课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图).课外小组的同学对混合后的废水中溶质的成分进行了探究.
(2012?丹阳市二模)课外小组的同学在参观废水处里厂时,得知除锈车间排放到甲废水池中含有的FeCl3、HCl与乙废水池中含有的KOH废水进行混合(如图).课外小组的同学对混合后的废水中溶质的成分进行了探究.