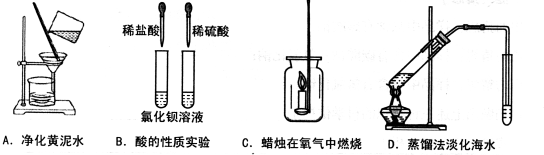
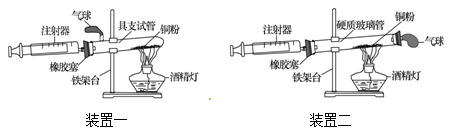
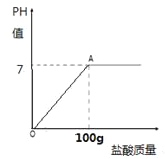
��Ŀ����
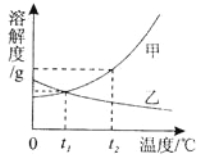
����Ŀ����װ�е���ˮ��A��B��C�ձ��зֱ����10g��25g��25gNaNO3���壬����ܽ��������ͼһ��ʾ��
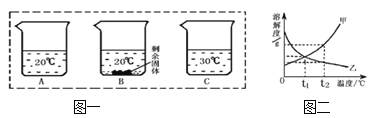
(1)�ձ��е���Һһ�����ڱ�����Һ���� ������ţ�����ͼ��֪���γɱ�����Һ��Ӱ�������� ��
(2)ͼ���ܱ�ʾNaNO3�ܽ�����ߵ��� ����ס����ҡ�����
(3)����ȥ���ڼ��е����������ʿɲ��õķ����� ��
(4)��ͼ�����������ֱ�100g�ס��ҵı�����Һ��t2�潵�µ�t1�棬��������Һ��������ȷ�� ������ţ���
A���ס��Ҷ��DZ�����Һ B�������ܼ���������<��
C����Һ��������>�� D������������������>��
���𰸡�(1)B���¶� (2)�ף�(3)���½ᾧ����ȴ�ȱ�����Һ�ᾧ�� (4)BD
��������
����������ձ��е���Һһ�����ڱ�����Һ����B����Ϊ������������û����ȫ�ܽ⣻��ͼ��֪���γɱ�����Һ��Ӱ���������¶���ͼ���ܱ�ʾNaNO3�ܽ�����ߵ��Ǽף���Ϊ�����Ƶ��ܽ�����¶ȵĶ����߶��������ȥ���ڼ��е����������ʿɲ��õķ����ǽ��½ᾧ����ȴ�ȱ�����Һ�ᾧ������ͼ�����������ֱ�100g�ס��ҵı�����Һ��t2�潵�µ�t1�棬��������Һ��������ȷ���ǣ������ܼ���������<�ң���Ϊt2����ܽ�ȴ����ң�����ͬ����������Һ���ܼ���������С�ǣ��Ҵ��ڼף�����������������>�ң���Ϊ����Ϊ�ҵ��ܽ�����¶ȵĽ��Ͷ����ߣ�����t2�浽t1��������ҵ�������������ı䣬�����ܽ�Ȼ��Ǵ����ң���������������������>�ҡ�