题目内容
【题目】如图是甲、乙两种固体物质的溶解度曲线.
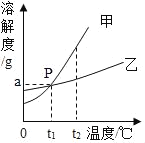
(1)由图可获得一条信息是_____.
(2)t2℃时,将不饱和的甲溶液转化成该温度下的饱和溶液的一种方法是_____,变化过程中,溶质的质量分数_____(选填“增大”“减小”或“不变”).
【答案】t1℃时甲和乙的溶解度相等 加入溶质 增大
【解析】
根据已有的溶解度曲线的意义进行分析解答,交点表示在该温度下两种物质的溶解度相等,根据溶解度曲线可以看出物质的溶解度受温度的变化情况,结合饱和溶液和不饱和溶液的转化以及溶解度随温度的变化特点确定析出晶体的方法进行分析解答。
(1)据图可以看出,在t1℃时甲和乙的溶解度相等;故填:t1℃时甲和乙的溶解度相等
(2)t2℃时,将不饱和的甲溶液转化成该温度下的饱和溶液可以使用加入溶质的方法。变化过程中,溶质的质量分数将增大,故填:加入溶质,增大

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】向碳酸氢镁[Mg(HCO3)2]溶液中加入一定量NaOH溶液,出现白色沉淀。某化学兴趣小组同学对该白色沉淀作如下探究:
(查阅资料)I.Mg(OH)2是一种难溶于水的白色固体,MgCO3是一种微溶于水的白色固体。
Ⅱ.Mg(OH)2、MgCO3受热均易分解,分别生成对应的两种氧化物。
Ⅲ.无水硫酸铜是一种白色固体,遇水变蓝。
(作出猜想)猜想一:只有Mg(OH)2;猜想二:只有MgCO3:;猜想三:_____。
(实验1)
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤1 | 取适量白色固体,加入足量的稀盐酸 | 有气泡产生 | 猜想_____不成立 |
步骤2 | 另取适量白色固体,充分加热,将产生的气体通入盛有无水硫酸铜的U形管 | _____ | 猜想二不成立 |
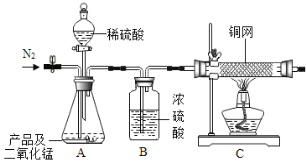
小张查阅资料得知上述固体是碱式碳酸镁[XMgCO3yMg(OH)23H2O],它不溶于水,受热易分解。
(实验2)
为进一步确定白色固体的组成,小张取一定量白色固体,按下图装置加热至固体质量不再改变,并测定各生成物的质量。
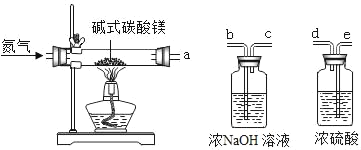
(1)反应结東后若没有继续通一会儿氮气就直接称量洗气瓶的质量,则测得的气体质量将_____(填:“偏大”、“偏小”或“不变”)
(2)为测定各生成物的质量,导管口的连接顺序为a→_____,_____→_____(填字母)。
(3)实验数据:加热完全后剩余固体质量3.20g;浓NaOH溶液增重2.64g;浓硫酸增重1.44g则:x:y=_____。
(拓展延伸)
碱式碳酸镁可作阻燃剂,其可能的原因是_____(选填字母)。
a生成的固体覆盖在燃烧物表面,隔绝氧气
b分解时吸热,使温度难以达到可燃物的着火点
c生成的气体降低了可燃物周围的氧气浓度