题目内容
某化工厂以生产氢氧化钠和氯气为主要产品,化学反应为:2NaCl+2H2O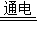 Cl2↑+H2↑+2NaOH.所产氯气主要供给自来水厂做消毒剂.若自来水厂每天需氯气7.1t.求:
Cl2↑+H2↑+2NaOH.所产氯气主要供给自来水厂做消毒剂.若自来水厂每天需氯气7.1t.求:(1)该厂每天至少需氯化钠固体的质量.
(2)用上述固体氯化钠配制26.5%的氯化钠溶液的质量为______.
(3)若该工厂每天用上述配制的氯化钠溶液生产氢氧化钠和氯气,通过上述化学反应制得的氢氧化钠溶液中溶质的质量分数为______ (列式即可).
【答案】分析:(1)根据7.1t氯气通过方程式列比例式求出氯化钠的质量;(2)用氯化钠的质量除以26.5%就是氯化钠溶液的质量;(3)先计算出生成的氢氧化钠的质量再除以反应后溶液质量.
解答:解:(1)设该厂每天至少需氯化钠固体的质量为x.
2NaCl+2H2O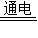 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
117 71
x 7.1 t
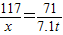
x=11.7 t
(2)氯化钠溶液的质量:11.7 t÷26.5%=44.15 t(或44.2 t)
(3)设生成氢氧化钠的质量为y,生成氢气的质量为z.
2NaCl+2H2O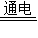 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
71 2 80
7.1t z y
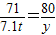 y=8 t
y=8 t 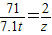 z=0.2 t
z=0.2 t
制得的氢氧化钠溶液中溶质的质量分数为: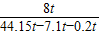 ×100%=21.7%
×100%=21.7%
故答案为:(1)11.7t;(2)44.15t;(3)21.7%.
点评:本题容易出错的地方是在计算氢氧化钠溶液质量分数时,计算反应后溶液质量往往忽略跑出去的氯气和氢气质量.
解答:解:(1)设该厂每天至少需氯化钠固体的质量为x.
2NaCl+2H2O
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH117 71
x 7.1 t
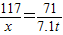
x=11.7 t
(2)氯化钠溶液的质量:11.7 t÷26.5%=44.15 t(或44.2 t)
(3)设生成氢氧化钠的质量为y,生成氢气的质量为z.
2NaCl+2H2O
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH71 2 80
7.1t z y
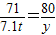 y=8 t
y=8 t 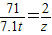 z=0.2 t
z=0.2 t制得的氢氧化钠溶液中溶质的质量分数为:
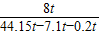 ×100%=21.7%
×100%=21.7%故答案为:(1)11.7t;(2)44.15t;(3)21.7%.
点评:本题容易出错的地方是在计算氢氧化钠溶液质量分数时,计算反应后溶液质量往往忽略跑出去的氯气和氢气质量.

练习册系列答案
相关题目
某化工厂按如下步骤进行生产:(1)以煤为燃料煅烧石灰石;(2)用饱和碳酸钠溶液充分吸收(1)中产生的二氧化碳(Na2CO3+CO2+H2O═2NaHCO3);(3)使步骤(1)中产生的氧化钙跟水反应;(4)熟石灰与碳酸钠溶液反应.该厂生产过程中所涉及的物质有①石灰石、②碳酸钠、③碳酸氢钠、④烧碱、⑤二氧化碳、⑥熟石灰( )
| A、起始原料是①、③ | B、起始原料是②、⑥ | C、最终产品是⑤、⑥ | D、最终产品是③、④ |