题目内容
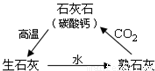
 李海同学做了如下实验:
李海同学做了如下实验:①在酒精灯上加热一块片状石灰石;
②灼烧一段时间后放在石棉网上冷却;
③把冷却后的固体投入盛有适量水的小烧杯中,并用温度计测量温度的变化;
④静置一段时间后,取上层清液于两支试管中,一支加入两滴无色酚酞试液,一支通入CO2气体;
⑤向烧杯中的剩余固体加入足量的稀盐酸.实验的部分变化如图所示.请回答以下问题:
(1)用温度计测量温度的变化,结果温度
升高
升高
(填“升高”或“降低”或“不变”).(2)加入酚酞试液的试管中的现象是
溶液变红
溶液变红
,该清液的pH>
>
7(填“>”或“<”或“=”).通入CO2的试管中发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
.(3)向烧杯中剩余固体加入足量稀盐酸,产生气泡的原因是
剩余固体中含部分未分解的CaCO3,与稀盐酸反应生成CO2
剩余固体中含部分未分解的CaCO3,与稀盐酸反应生成CO2
.分析:(1)利用物质反应时温度的变化来判断;
(2)通过判断溶液的酸碱性来判断酚酞使试剂的颜色变化情况以及溶液的pH;
(3)通过分析剩余固体中的成分从而判断产生气泡的原因.
(2)通过判断溶液的酸碱性来判断酚酞使试剂的颜色变化情况以及溶液的pH;
(3)通过分析剩余固体中的成分从而判断产生气泡的原因.
解答:解:(1)片状石灰石在酒精灯上灼烧一段时间后有氧化钙生成,然后放入盛有适量水的小烧杯中,氧化钙和水发生化学反应,同时放出大量的热.故答案为升高.
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙的水溶液显碱性,能使无色酚酞溶液变红.往氢氧化钙溶液中通入二氧化碳气体会发生化学反应生成碳酸钙沉淀和水.故答案为:溶液变红;>;Ca(OH)2+CO2=CaCO3↓+H2O
(3)因为片状石灰石在加热时碳酸钙没完全分解,导致向烧杯中剩余固体加入足量稀盐酸时会有气泡冒出.故答案为:剩余固体中含部分未分解的CaCO3,与稀盐酸反应生成CO2
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙的水溶液显碱性,能使无色酚酞溶液变红.往氢氧化钙溶液中通入二氧化碳气体会发生化学反应生成碳酸钙沉淀和水.故答案为:溶液变红;>;Ca(OH)2+CO2=CaCO3↓+H2O
(3)因为片状石灰石在加热时碳酸钙没完全分解,导致向烧杯中剩余固体加入足量稀盐酸时会有气泡冒出.故答案为:剩余固体中含部分未分解的CaCO3,与稀盐酸反应生成CO2
点评:本题重点考查物质反应时温度的变化和指示剂的变色情况以及碳酸钙的有关化学性质.通过本题可锻炼学生的逻辑推理能力以及分析能力.

练习册系列答案
相关题目
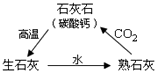 李海同学做了如下实验:
李海同学做了如下实验: