题目内容
【题目】在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行如下实验:
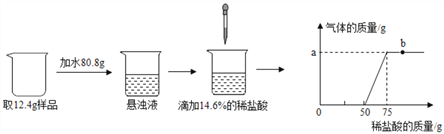
根据实验过程和图象提供的信息,回答下列问题:
(1) b点溶液中的溶质为__________(填化学式)。
(2) 完全反应后生成气体的质量是_________g?
(3) 样品中氢氧化钙的质量分数为________?
【答案】 CaCl2和HCl 2.2g 59.7%
【解析】(1)根据b点时稀盐酸已经与氢氧化钙和碳酸钙完全反应且稀盐酸过量分析解答;(2)根据稀盐酸与碳酸钙反应消耗的稀盐酸的质量求解生成二氧化碳的质量及样品中反应的碳酸钙的质量的质量;(3)根据碳酸钙的质量求解氢氧化钙的质量,从而求解样品中氢氧化钙的质量分数。(1) b点溶液中的溶质为CaCl2和HCl,因为稀盐酸已经与氢氧化钙和碳酸钙完全反应,生成氯化钙,稀盐酸过量含有氯化氢气体;
(2)设样品中碳酸钙的质量为x,完全反应后生成气体的质量为y。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x (75-50)g×14.6% y

x=5g
y=2.2g
(3)样品中氢氧化钙的质量分数为![]() ×100%=59.7%
×100%=59.7%
答:(2) 完全反应后生成气体的质量是2.2;(3) 样品中氢氧化钙的质量分数为59.7%。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目