题目内容
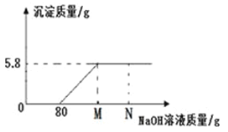
【题目】取一定质量的氢氧化钠和碳酸钠的混合物完全溶于水,得到50g溶液,再向溶液中滴加45g石灰水,恰好完全反应,生成了10g沉淀。若氢氧化钠和碳酸钠混合物中钠元素的质量为9.2g,试计算:
(1)混合物中氢氧化钠的质量。
(2)恰好完全反应时,所得溶液中溶质质量分数(结果精确至0.1%)。
【答案】(1)8g(2)18.8%
【解析】
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠和氯化钙不反应。
解:设原混合物中碳酸钠的质量为![]() ,生成氢氧化钠的质量为
,生成氢氧化钠的质量为![]() ,
,

![]()
![]()
解得![]() =10.6g
=10.6g ![]() =8g
=8g
所以10.6g Na2CO3中含有的钠元素的质量为10.6g×![]() =4.6g;
=4.6g;
原混合物中氢氧化钠中含有的钠元素的质量为9.2g-4.6g=4.6g
所以原混合物中氢氧化钠的质量为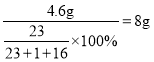
所得溶液中溶质的质量为8g+8g=16g,
溶液的质量为50g+45g-10g=85g
溶质的质量分数为![]() 。
。
答:(1)混合物中氢氧化钠的质量8g。
(2)恰好完全反应时,所得溶液中溶质质量分数18.8%.

【题目】已知某矿石主要成分是MgO,另外还含有少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg (OH) 2的工艺流程简图如下:
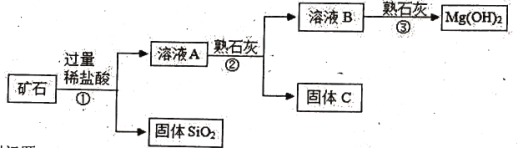
回答下列问题:
(1)请标出二氧化硅中硅元素的化合价______,步骤①和步骤②均用到某种操作,此操作中会用到的玻璃仪器有_____(写一种)。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、 Mg2+和_____(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的pH范围为_________。
步骤③制得Mg (OH) 2的化学方程式为_____.