题目内容
根据图示情景和范例,编写计算题,并完成相关内容.
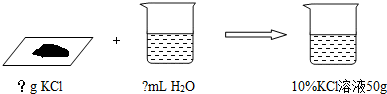
【情景1】要配制一定质量分数、一定质量的氯化钾溶液,应该怎么操作?
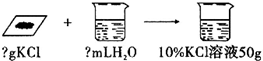
(1)编题范例:配制10%的氯化钾溶液50g,分别需氯化钾固体和水各多少?
(2)配制该溶液的操作步骤
①计算:需要KCl ,水 ;
②称量:用托盘天平称取所需固体,再用 mL的量筒取所需的水;
③溶解:将称得的氯化钾固体放人烧杯中,再倒入量取的水,用玻璃棒充分搅拌;
④装瓶:将配制的溶液倒人试剂瓶,并贴上标签.
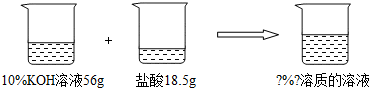
【情景2】已知一定质量分数、一定质量的氢氧化钾溶液与一定质量的盐酸反应,得到只有一种溶质的溶液,求反应后溶液的溶质质量分数.
(1)编写题目:
(2)计算过程: .
【情景1】要配制一定质量分数、一定质量的氯化钾溶液,应该怎么操作?
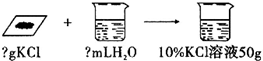
(1)编题范例:配制10%的氯化钾溶液50g,分别需氯化钾固体和水各多少?
(2)配制该溶液的操作步骤
①计算:需要KCl
②称量:用托盘天平称取所需固体,再用
③溶解:将称得的氯化钾固体放人烧杯中,再倒入量取的水,用玻璃棒充分搅拌;
④装瓶:将配制的溶液倒人试剂瓶,并贴上标签.
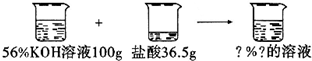
【情景2】已知一定质量分数、一定质量的氢氧化钾溶液与一定质量的盐酸反应,得到只有一种溶质的溶液,求反应后溶液的溶质质量分数.

(1)编写题目:
(2)计算过程:
分析:【情景1】(2)①溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量,体积=质量÷密度;
②量筒的选用,容量需大于称量的溶液体积;
【情景2】(1)编写的题目要结合情景中的图示内容和数据;
(2)利用氢氧化钾与盐酸反应的化学方程式和氢氧化钾的质量,列出比例式,就可计算出生成氯化钾的质量(即溶质质量),然后根据溶质质量分数公式计算即可.
②量筒的选用,容量需大于称量的溶液体积;
【情景2】(1)编写的题目要结合情景中的图示内容和数据;
(2)利用氢氧化钾与盐酸反应的化学方程式和氢氧化钾的质量,列出比例式,就可计算出生成氯化钾的质量(即溶质质量),然后根据溶质质量分数公式计算即可.
解答:解:【情景1】(2)①需氯化钾固体的质量为:50g×10%=5g;
需水的质量为:50g-5g=45g,水的体积为:45g÷1g/mL=45mL;故答案为:5g;45mL;
②因为所需水的体积为45mL,故需用容量为50mL的量筒量取所需的水;故答案为:50;
【情景2】(1)56g10%的氢氧化钾溶液与18.5g某浓度的盐酸恰好完全反应,计算反应所得溶液中溶质的质量分数.
(2)解:设完全反应后,生成氯化钾的质量为x,
KOH+HCl=KCl+H2O
56 74.5
56g×10% x
=
解得:x=7.45g;
反应所得溶液中溶质的质量分数为:
×100%=10%.
答:反应所得溶液中溶质的质量分数为10%.
需水的质量为:50g-5g=45g,水的体积为:45g÷1g/mL=45mL;故答案为:5g;45mL;
②因为所需水的体积为45mL,故需用容量为50mL的量筒量取所需的水;故答案为:50;
【情景2】(1)56g10%的氢氧化钾溶液与18.5g某浓度的盐酸恰好完全反应,计算反应所得溶液中溶质的质量分数.
(2)解:设完全反应后,生成氯化钾的质量为x,
KOH+HCl=KCl+H2O
56 74.5
56g×10% x
| 56 |
| 56g×10% |
| 74.5 |
| x |
解得:x=7.45g;
反应所得溶液中溶质的质量分数为:
| 7.45g |
| 56g+18.5g |
答:反应所得溶液中溶质的质量分数为10%.
点评:本题主要考查学生的实验操作能力和利用化学方程式和溶质质量分数公式计算的能力.本题考查的知识点较多,涉及面较广,答题时需认真分析已知条件,调动所学知识,沉着应对.

练习册系列答案
相关题目