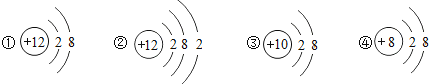
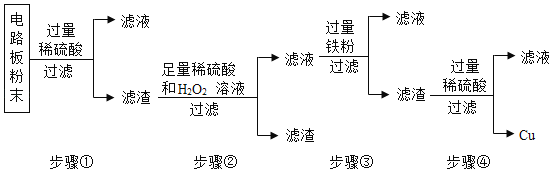
题目内容
【题目】将50gCaCl2溶液与60gNa2CO3溶液混合后,恰好完全反应。过滤得到100g滤液。请计算:
(1)反应后生成CaCO3沉淀的质量为___________;
(2)反应后所得溶液中溶质的质量分数___________。(结果精确到0.1%)
【答案】10g 11.7%
【解析】
(1)根据质量守恒定律分析生成的CaCO3沉淀的质量;
(2)根据反应的化学方程式,由CaCO3沉淀的质量可以求出生成氯化钠的质量;根据溶质质量的计算公式求出所得溶液中溶质的质量分数进行解答。
解:(1)根据质量守恒定律可知,反应后生成CaCO3沉淀的质量为:50g+60g-100g=10g;(2)设生成NaCl的质量为x,
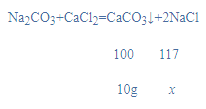
![]()
x=11.7g,
所得溶液中溶质的质量分数为![]() ×100%=11.7%。
×100%=11.7%。

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共6g放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),
请分析表中数据,完成下列问题:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 5.20 | 4.60 | 4.20 | 4.10 | 4.08 |
(1)完全反应时,生成氧气的质量为_____g;
(2)原混合物中氯酸钾的质量分数是__________?(计算结果精确到0.1%)