��Ŀ����
����Ŀ����ҵ�����г�����ʳ�Σ�ij������Ϊ�˲ⶨһ���������� Na2CO3���������������������·���ʵ�飺ȡ������Ʒ�������ձ��У���ˮ����ܽ⣬�����μ�ϡ���ᣬ������������Ϊֹ�� �й����������ʾ��
���� | ��Ʒ���� | ˮ������ | ����ϡ�������� | ��Ӧ����Һ���� |
������g�� | 22 | 50 | 146 | 209.2 |
��1����Ӧ��|ʱ������������̼������Ϊ ��
��2���������� Na2CO3����������������������ȷ�� 0.1%����ͬ��
��3������ϡ�������������������
���𰸡���1��8.8g����2��96.4%����3��10%��
����������1�����ɶ�����̼������Ϊ��22g+50g+146g��209.2g=8.8g��
��2����μӷ�Ӧ��̼��������Ϊx����������Ϊy��
Na2CO3+2HCl�T2NaCl+CO2��+H2O
106 73 44
x y 8.8g
![]() =
=![]() =
=![]()
x=21.2g
y=14.6g
����̼���Ƶ���������Ϊ��![]() ��100%=96.4%��
��100%=96.4%��
��3��ϡ�����������������Ϊ��![]() ��100%=10%��
��100%=10%��

 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�����Ŀ����Դ�����������DZ�֤�ҹ��ɳ�����չ�Ĺؼ�����ش��������⣺
��1�����ڣ��ҹ������Ի�ʯȼ��Ϊ��Ҫ��Դ��������������Ļ�ʯȼ�ϰ���ú�� ����Ȼ���ȣ��������� ������Դ����ɡ����ɡ�����
��2����ѧ��ӦҲ������������������з�Ӧ�����л�ų��������� �������ţ�
A����ʯ����ˮ B��̼�������̼ C��þ������
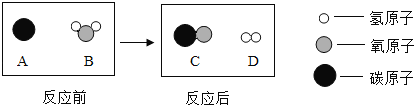
��3��Ϊ���ٻ�����Ⱦ�����ú�������ʣ��ɽ���ת��Ϊ��ȼ�����壬�˹��̿���Ϊ��̼��ˮ�ķ�Ӧ������ʾ��ͼ��ͼ��ʾ���÷�Ӧ�Ļ�ѧ����ʽΪ ��������Ӧ����Ϊ ��
��4��Ϊ�˼��ٻ�����Ⱦ���������壬����Ŭ�����ٶԻ�ʯȼ�ϵ����������о�����NH3ȼ�յIJ���Ҳû����Ⱦ�����ͷŴ�����������Ϊȼ������ijЩ���滹����H2��
�ٽ�NH3ȼ�շ�Ӧ�Ļ�ѧ����ʽ����������4NH3+3O2![]() 6H2O+ ��
6H2O+ ��
��������±���Ϣ������NH3ȡ��H2���ŵ㣺
��ɫ����ζ | �۵㣨�棩 | �е㣨�棩 | ����ʱ��1Lˮ�����ܽ��������� | ������ܶ� ��g/L�� | |
NH3 | ��ɫ���̼��� | ��77.7 | ��33 | 700L | 0.6942 |
H2 | ��ɫ����ζ | ��259.2 | ��253 | 0.017L | 0.0899 |
����NH3��H2�е�ߣ����Ը��� �����ڴ�������䣮NH3й©ʱ��������Ϊ ��ͬʱ��������ˮ�����ڴ�����
