题目内容
【题目】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:
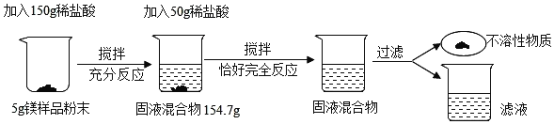
请回答下列问题:
(1)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式_____。
(2)此镁样品中镁的质量分数为_____。
(3)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为_____。
(4)若将反应后的滤液蒸发104.4 g水,无晶体析出,所得溶液中溶质的质量分数为_____。
(5)若要生产含镁4.5%的铝合金960 t,需要上述金属镁样品的质量为_____。
【答案】![]() 96% 40g 19% 45t
96% 40g 19% 45t
【解析】
实验过程中发生反应是镁和盐酸反应生成氯化镁和氢气,对应的化学方程式为 Mg+2HCl=MgCl2+H2↑。
由于所加盐酸为同一盐酸,且根据第一次150g稀盐酸完全反应生成氢气的质量=5g+150g-154.7g=0.3g,所以继续加入50g稀盐酸恰好完全反应,则生成的氢气的质量总量为0.4g。
(1)设:第一次所加的稀盐酸中溶质质量为x
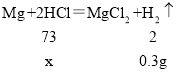
![]() 。
。
(2)设镁样品中镁的质量分数为y,消耗的盐酸的质量分数为z,生成的氯化镁的质量为m

![]()
y=96%
z=7.3%
m=19g。
(3)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为![]() =40g。
=40g。
(4)若将反应后的滤液蒸发104.4 g水,无晶体析出,所得溶液中溶质的质量分数为 ![]() ×100%=19%。
×100%=19%。
(5)若要生产含镁4.5%的铝合金960 t,需要上述金属镁样品的质量为960t×4.5%÷96%=45t。

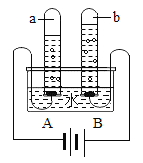
【题目】小周同学利用如图所示的装置探究物质与水作用时热量变化的情况,请参与完成如下表所示实验现象的记录,并回答有关问题:

试管中加入的物质 | 硝酸铵 | 食盐 | 浓硫酸 | 生石灰 |
U型管中红水柱的变化 | A上B下 | 基本不变 | A下B上 | ______ |
(1)写出生石灰与水反应的化学方程式:________,反应时会_______热量。
(2)若某同学因重感冒高烧不退,你会选用上述四种物质中的_______溶于水速制一个冰袋用于冷敷,其理由是_______。