题目内容
有10gCO和CO2的混合气体与足量的CuO充分反应后得到12.8g金属铜,求原混合气体中碳元素的质量分数.
【答案】分析:根据已知量12.8g金属铜,设出一氧化碳的质量,根据CO+CuO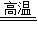 Cu+CO2,求出一氧化碳的质量,再求出二氧化碳的质量,然后根据两种气体中碳元素的质量分数,求出碳元素的质量,比上气体的总质量即是混合气体中碳元素的质量分数.
Cu+CO2,求出一氧化碳的质量,再求出二氧化碳的质量,然后根据两种气体中碳元素的质量分数,求出碳元素的质量,比上气体的总质量即是混合气体中碳元素的质量分数.
解答:解:
方法一:设混合气体中CO的质量为x
CO+CuO Cu+CO2
Cu+CO2
28 64
x 12.8g
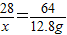
解得x=5.6g
所以二氧化碳的质量为 10g-5.6g=4.4g
原混合气体中碳元素的质量=5.6g×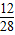 ×100%+4.4g×
×100%+4.4g×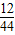 ×100%=3.6g
×100%=3.6g
原混合气体中碳元素的质量分数= ×100%=36%
×100%=36%
方法二:设反应后气体增加质量为x
CO+CuO Cu+CO2 气体质量增加
Cu+CO2 气体质量增加
28 64 44 16
12.8g x
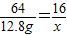
解得x=3.2g
所以二氧化碳的总质量为:10g+3.2g=13.2g
原混合气体中碳元素的质量=13.2g×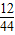 ×100%=3.6g
×100%=3.6g
原混合气体中碳元素的质量分数=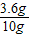 ×100%=36%
×100%=36%
答:原混合气体中碳元素的质量分数为36%.
点评:在解此类题时,首先分析题中的反应原理,然后结合题中方程式中的等量关系进行分析解答需要的数据,再结合题意进行计算.
 Cu+CO2,求出一氧化碳的质量,再求出二氧化碳的质量,然后根据两种气体中碳元素的质量分数,求出碳元素的质量,比上气体的总质量即是混合气体中碳元素的质量分数.
Cu+CO2,求出一氧化碳的质量,再求出二氧化碳的质量,然后根据两种气体中碳元素的质量分数,求出碳元素的质量,比上气体的总质量即是混合气体中碳元素的质量分数.解答:解:
方法一:设混合气体中CO的质量为x
CO+CuO
 Cu+CO2
Cu+CO2 28 64
x 12.8g
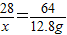
解得x=5.6g
所以二氧化碳的质量为 10g-5.6g=4.4g
原混合气体中碳元素的质量=5.6g×
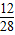 ×100%+4.4g×
×100%+4.4g×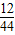 ×100%=3.6g
×100%=3.6g原混合气体中碳元素的质量分数=
 ×100%=36%
×100%=36%方法二:设反应后气体增加质量为x
CO+CuO
 Cu+CO2 气体质量增加
Cu+CO2 气体质量增加28 64 44 16
12.8g x
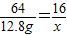
解得x=3.2g
所以二氧化碳的总质量为:10g+3.2g=13.2g
原混合气体中碳元素的质量=13.2g×
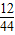 ×100%=3.6g
×100%=3.6g原混合气体中碳元素的质量分数=
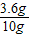 ×100%=36%
×100%=36%答:原混合气体中碳元素的质量分数为36%.
点评:在解此类题时,首先分析题中的反应原理,然后结合题中方程式中的等量关系进行分析解答需要的数据,再结合题意进行计算.

练习册系列答案
相关题目