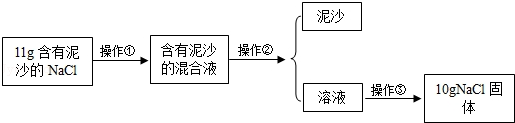
题目内容
请你参与配制一定溶质质量分数的氢氧化钠溶液,并进行有关计算。
(1)小红同学在实验室欲配制10%的氢氧化钠溶液143g,请回答:
①配制 10%的氢氧化钠溶液143g,需要40%的氢氧化钠溶液(密度为1.43g/cm3) mL,加水 mL
(结果保留一位小数)。
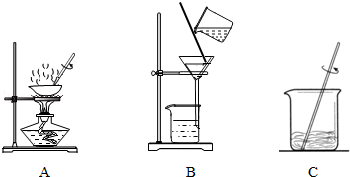
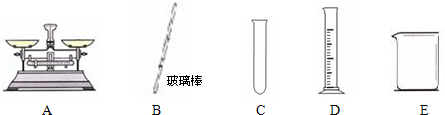
②实验中,必需用到的仪器有 。
(2)将一定质量的二氧化碳通入 200g10%的氢氧化钠溶液中,恰好完全反应,反应的化学方程式为 ,生成的碳酸钠的质量是 g。
(1)小红同学在实验室欲配制10%的氢氧化钠溶液143g,请回答:
①配制 10%的氢氧化钠溶液143g,需要40%的氢氧化钠溶液(密度为1.43g/cm3) mL,加水 mL
(结果保留一位小数)。
②实验中,必需用到的仪器有 。

(2)将一定质量的二氧化碳通入 200g10%的氢氧化钠溶液中,恰好完全反应,反应的化学方程式为 ,生成的碳酸钠的质量是 g。
(1)①25;107.3;②BDE;(2)2NaOH+CO2=Na2CO3+H2O;26.5
试题分析:(1)溶液配制过程中,溶质的质量保持不变,这是计算的基础和理论依据。由于采用的是氢氧化钠溶液,所以氢氧化钠溶液也要计算出体积,进而进行量取。配制过程中,由于都是溶液,所以不用托盘天平,而是用量筒,用到烧杯进行稀释,稀释过程中需要玻璃棒进行搅拌。
①配制10%的氢氧化钠143g,所需要的40%的氢氧化钠溶液的质量为x,则
根据溶液稀释前后溶质的质量保持不变可得
10%×143g=40%×x
解得x=35.75g
对应的体积=
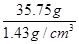 =25cm3=25mL
=25cm3=25mL加入的水的质量为143g-35.75g=107.25g≈107.3g
则水对应的体积为
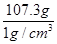 =107.3cm3=107.3mL
=107.3cm3=107.3mL②由于稀释过程都是液体,所以用量筒而不用托盘天平.稀释需要在烧杯中进行,同时需要玻璃棒搅拌.因此用到的仪器为BDE。
(2)二氧化碳与氢氧化钠恰好反应有三种可能:氢氧化钠完全转化为碳酸钠;氢氧化钠转化为碳酸氢钠和碳酸钠;氢氧化钠转化为碳酸氢钠.而题目要求计算碳酸钠的质量,所以是假设只生成了碳酸钠,其他情况不考虑。
对应的反应方程式为2NaOH+CO2=Na2CO3+H2O
设200g10%的氢氧化钠完全转化为碳酸钠时,生成的碳酸钠的质量为y
2NaOH+CO2=Na2CO3+H2O
80 106
200g×10% y
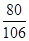 =
=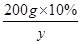
解得y=26.5g

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目