题目内容
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下研究。
高纯CaO的制备
【资料卡】
Ⅰ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.无水硫酸铜遇水变成蓝色的硫酸铜晶体。
Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去。
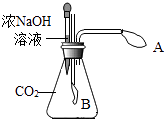
(1)甲同学用如下装置制备CaO并验证石膏与焦炭高温反应的其他产物。
实验过程中发现:B中无水硫酸铜变蓝,现象证明有SO2生成,装置D的作用 , 当观察到现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:。
(2)铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
① 浸泡、过滤过程中加入过量的试剂X目的是。试剂X是一种常见的强碱,明矾是一种硫酸盐,化学式为KAl(SO4)2·12H2O。
② 聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型混凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
a 最适合作为混凝剂聚合硫酸铁的洗涤液为 , 选择该洗涤液的优点、。
b 请用含y的代数式表示x的数值:x =。
c 水解过程中,溶液的pH与x的关系如下图所示。溶液的pH=3.0时聚合硫酸铁中x的数值达到最大值。加入试剂 Fe2O3目的是。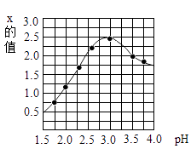
【答案】
(1)C中品红溶液褪色,吸收(或者除去)SO2,E中品红不褪色(或者无明显变化)、F中澄清石灰水变浑浊,2CaSO4?2H2O + C ![]() 2CaO+2SO2↑+CO2↑+4H2O
2CaO+2SO2↑+CO2↑+4H2O
(2)将铝、铁分离,乙醇(酒精),聚合硫酸铁微溶于乙醇(酒精),乙醇(酒精)易挥发便于干燥,6-2y,调节混合溶液的pH
【解析】解:(1)高纯CaO的制备实验过程中发现:B中无水硫酸铜变蓝(说明生成了水);根据信息提示“SO2能使品红溶液褪色“,而结论是证明有二氧化硫生成,所以对应的现象为C中的品红溶液褪色现象;装置D是吸收二氧化硫,而导致高锰酸钾褪色;E装置的作用是证明二氧化硫已经完全被吸收,后面若石灰水变浑浊,则是二氧化碳所致,而非二氧化硫.所以证明二氧化碳生成的现象是装置 E中无明显变化(无二氧化硫的干扰)和装置F中 澄清石灰水变浑浊现象(有二氧化碳);碳粉在高温条件下生成氧化钙、水、二氧化碳和二氧化硫,对应的化学方程式为:2CaSO42H2O+C ![]() 4H2O↑+2CaO+2SO2↑+CO2↑。(2) ①浸泡、过滤过程中加入过量的试剂X目的是将铝、铁分离.由于铝是两性金属,既能与酸反应,也能与强碱反应,所以应该是加入了强碱,而根据明矾的化学式为KAl(SO4)212H2O可知组成元素含有钾,根据质量守恒定律可知加入的强碱试剂X 应为 KOH.聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型混凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n;②絮凝原理参照明矾进行分析,所以混凝剂聚合硫酸铁可用于净水的原理是:聚合硫酸铁具有吸附作用,吸附悬浮颗粒,形成较大颗粒而沉降;根据化合物中化合价的代数和为零,且铁为+3价,氢氧根为-1价,硫酸根为-2价,则有(+3)×2+(-1)×x+(-2)×y=0.则有x=6-2y;水解过程中,溶液的pH与x的关系如图2所示.由图可知溶液的pH=3时聚合硫酸铁中x的数值达到最大值.所以加入试剂 Fe2O3的目的是调节混合溶液pH到3,以使聚合硫酸铁中x的数值达到最大值。
4H2O↑+2CaO+2SO2↑+CO2↑。(2) ①浸泡、过滤过程中加入过量的试剂X目的是将铝、铁分离.由于铝是两性金属,既能与酸反应,也能与强碱反应,所以应该是加入了强碱,而根据明矾的化学式为KAl(SO4)212H2O可知组成元素含有钾,根据质量守恒定律可知加入的强碱试剂X 应为 KOH.聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型混凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n;②絮凝原理参照明矾进行分析,所以混凝剂聚合硫酸铁可用于净水的原理是:聚合硫酸铁具有吸附作用,吸附悬浮颗粒,形成较大颗粒而沉降;根据化合物中化合价的代数和为零,且铁为+3价,氢氧根为-1价,硫酸根为-2价,则有(+3)×2+(-1)×x+(-2)×y=0.则有x=6-2y;水解过程中,溶液的pH与x的关系如图2所示.由图可知溶液的pH=3时聚合硫酸铁中x的数值达到最大值.所以加入试剂 Fe2O3的目的是调节混合溶液pH到3,以使聚合硫酸铁中x的数值达到最大值。
所以答案是:(1)C中品红溶液褪色;吸收(或者除去)SO2;E中品红不褪色(或者无明显变化)、F中澄清石灰水变浑浊;2CaSO42H2O + C![]() 2CaO+2SO2↑+CO2↑+4H2O;(2) ①将铝、铁分离;②乙醇(酒精);聚合硫酸铁微溶于乙醇(酒精);乙醇(酒精)易挥发便于干燥;6-2y;调节混合溶液的pH。
2CaO+2SO2↑+CO2↑+4H2O;(2) ①将铝、铁分离;②乙醇(酒精);聚合硫酸铁微溶于乙醇(酒精);乙醇(酒精)易挥发便于干燥;6-2y;调节混合溶液的pH。
【考点精析】本题主要考查了质量守恒定律及其应用和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;注意:a、配平 b、条件 c、箭号才能正确解答此题.

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 , 某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备
【资料卡】实验室用熟石灰和硫酸铵固体混合共热制取氨气,NO2有毒,常温下为红棕色,常用氢氧化钠溶液进行尾气处理;同温同压下,不同气体的体积之比等于分子个数之比。
① 氨气的发生装置可以选择上图中的。
② 预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。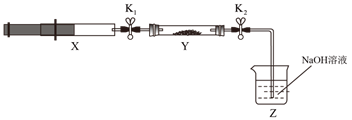
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ① Y管中 | ② 反应的化学方程式: |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |