题目内容
【题目】食盐是一种重要的化工原料,回答下列问题
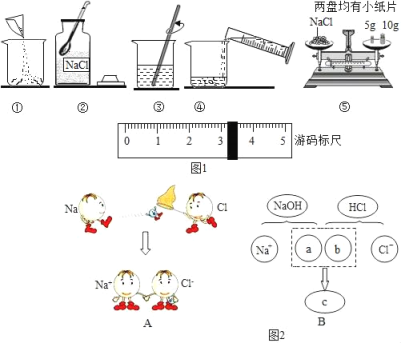
(1)粗盐中含有的难溶性杂质,甲同学在实验室里通过如图1所示的实验步骤将其去除.
①过滤所用的玻璃仪器有:烧杯、漏斗和_____.
②在加热蒸发过程中,当蒸发皿中出现_____固体时,停止加热,利用蒸发皿的余热将滤液蒸干.
③在本实验中,先称取5g粗盐,再量取10ml水,加粗盐至不再溶解为止时称得剩余粗盐质量为1g,通过如图1实验步骤最终得到3.5g精盐,则精盐的产率是_____.
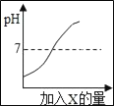
(2)利用上述实验得到的精盐中还含有少量氯化镁、氯化钙、硫酸钠等杂质,乙同学用天平称量一定量的含氯化镁、氯化钙、硫酸钠的精盐,并设计了如图2所示过程进行除杂提纯,实验后得到较纯净的氯化钠固体(此题中微溶物视为可溶物).
①沉淀A中共含有_____种物质(填字母).
A 2 B 3 C 4 D 5
②滤液B中加适量稀盐酸的作用是除去_____.
(3)氯化钠固体与浓硫酸在加热条件下反应生成硫酸钠和氯化氢气体.写出此反应的化学方程式_____.
【答案】玻璃棒 较多 87.5% C 碳酸钠和氢氧化钠 ![]()
【解析】
(1)①过滤所用的玻璃仪器有:烧杯、漏斗和玻璃棒.
②在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将滤液蒸干.
③由题意可知,精盐的产率是:![]() =87.5%.
=87.5%.
(2)①由于氯化镁与氢氧化钠反应生成了氢氧化镁沉淀、氯化钡与硫酸钠反应生成了硫酸钡沉淀、碳酸钠与与氯化钙、氯化钡反应生成了碳酸钙和碳酸钡沉淀,所以沉淀A中共含有4种物质;
②由于溶液中有过量的氢氧化钠和碳酸钠,所以加入盐酸的目的是除去碳酸钠和氢氧化钠.
(3)氯化钠固体与浓硫酸在加热条件下反应生成硫酸钠和氯化氢气体.此反应的化学方程式2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
故答为:(1)①和玻璃棒.②较多.③87.5%.
(2)①C;②碳酸钠和氢氧化钠.
(3)2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑.
Na2SO4+2HCl↑.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】科学学习小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
(假设猜想)针对疑问,大家纷纷提出猜想.猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4 猜想三:_____
(实验探究)取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有_____.学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铁丝、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出
(实验探究)中存在两处明显错误,同学们经过反思发现了这两处错误:
(1)实验操作中的错误是_____.
(2)实验方案中也有一个是错误,应如何改进_____.
【题目】自来水消毒过程中常发生下列转化:
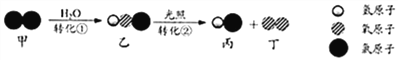
下列说法正确的是 ( )
A. 反应前后分子不可分 B. 转化①是化合反应
C. 转化②中丙和丁的分子个数之比为1︰1 D. 转化①、②中氯元素的化合价都发生变化
【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |