题目内容
【题目】实验室新进一批块状大理石。某化学小组成员称取 12.5g 该大理石样品,加入足量稀盐酸测定碳酸钙的含量。完全反应后,称得固体剩余物的质量为 2.5 g。样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:
(1)该样品中碳酸钙的质量为_________________。
(2)写出实验室检验二氧化碳的化学方程式_________________。
(3)计算 12.5 g 该样品最多可制得二氧化碳的质量,写出必要的计算过程_________________。
【答案】10g CO2+Ca(OH)2 ==CaCO3↓+H2O 4.4g
【解析】
解:(1)固体减少的质量是参加反应的碳酸钙的质量,完全反应后,称得固体剩余物的质量为 2.5 g,则2.5g是该大理石样品中杂质的质量,所以该样品中碳酸钙的质量为:12.5g-2.5g=10g。
(2)检验二氧化碳用澄清石灰水,澄清石灰水是氢氧化钙溶液,检验二氧化碳的化学方程式为:CO2+Ca(OH)2 ==CaCO3↓+H2O。
(3)设12.5 g 该样品最多可制得二氧化碳的质量为x。
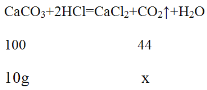
![]() =
=![]() ,解得x=4.4g
,解得x=4.4g

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目