题目内容
【题目】(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有 性。(1分)
(2)某探究小组的同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定.取50g废水于烧杯中,加入足量BaCl2溶液、过滤、洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
①计算50g废水中H2SO4的溶质质量分数。(3分,要求写出计算过程)
②若改用KOH溶液(利用消耗的KOH的质量)测定50g废水中H2SO4的含量,结果可能会 ______(选填“偏低”、“偏高”或“不变”),原因是____________________。(每空1分,计2分)
【答案】(1)吸水 (2)①9.8% ②偏高 ; 废水中含有硝酸,硝酸也会消耗氢氧化钾
【解析】
试题分析:(1)浓硫酸具有吸水性;(2)①根据硫酸钡质量,利用化学方程式进行计算,具体步骤如下:
解:设废水中含硫酸的质量为x
H2SO4+BaCl2=BaSO4↓+2HCl (1分)
98 233
x 11.65g
![]()
x=4.9g (1分)
所以废水中H2SO4的溶质质量分数为![]() ×100%=9.8% (1分)
×100%=9.8% (1分)
答:(略)
②若改用氢氧化钾,利用消耗的KOH的质量)测定50g废水中H2SO4的含量,结果可能会偏高 ; 因为废水中含有硝酸,硝酸也会消耗氢氧化钾,消耗氢氧化钾的质量增加,所以结果会偏高。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反虚后的产物。
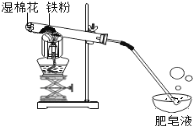
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
