题目内容
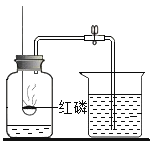
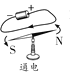
【题目】利用图中装置进行实验(两支玻璃管内径相同)。实验前K1、K2、K3均已关闭。
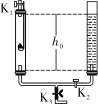
(实验1)制备气体
左管中的燃烧匙盛有足量二氧化锰颗粒,右管盛有过氧化氢溶液
Ⅰ、打开K1和K2,反应发生
Ⅱ、 在K1的导管口收集气体
Ⅲ、 ……
(实验2)测定空气中氧气含量
左管中燃烧匙盛有足量白磷,右管盛有水
Ⅰ、光照引燃白磷
Ⅱ、待白磷熄灭,冷却,打开K2,至液面不再变化,右管中液体的高度为h1
(1)实验1:反应的化学方程式为_____;为使反应停止,Ⅲ中的操作是_____。
(2)实验2:打开K2,右管中液面下降,原因是_____;计算空气中氧气体积分数的表达式为_____(用h0、h1表示)。
【答案】2H2O2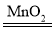 2H2O+O2↑ 关闭K1 左侧玻璃管内白磷燃烧消耗氧气,压强变小,右管中液体被压入左管
2H2O+O2↑ 关闭K1 左侧玻璃管内白磷燃烧消耗氧气,压强变小,右管中液体被压入左管 ![]() ×100%
×100%
【解析】
(1)过氧化氢在二氧化锰催化条件下分解的化学方程式为2H2O2![]() 2H2O+O2↑;打开K1、K2,右侧过氧化氢溶液进入左侧,与二氧化锰颗粒接触,开始反应,若关闭K1,气体无法导出,则会将左侧过氧化氢溶液压回右侧,使得二氧化锰固体颗粒与过氧化氢溶液分离,反应停止。(2)白磷与氧气反应生成五氧化二磷,使得左管中压强变小,所以打开K2时,右管中液体会进入左管;右管中液体高度为h1,则说明液体减少了(h0-h1),即相当于消耗的氧气的体积,则空气中氧气的体积分数为
2H2O+O2↑;打开K1、K2,右侧过氧化氢溶液进入左侧,与二氧化锰颗粒接触,开始反应,若关闭K1,气体无法导出,则会将左侧过氧化氢溶液压回右侧,使得二氧化锰固体颗粒与过氧化氢溶液分离,反应停止。(2)白磷与氧气反应生成五氧化二磷,使得左管中压强变小,所以打开K2时,右管中液体会进入左管;右管中液体高度为h1,则说明液体减少了(h0-h1),即相当于消耗的氧气的体积,则空气中氧气的体积分数为![]() ×100%。
×100%。

【题目】依据下列20℃时的实验和数据回答问题。
已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g。
| 序号 | ① | ② | ③ | ④ | ⑤ |
固体种类 | NaCl | NaCl | NaNO3 | NaNO3 | NaNO3 | |
固体的质量/g | 30 | 60 | 30 | 60 | 90 | |
水的质量/g | 100 | 100 | 100 | 100 | 100 |
(1)①~⑤所得溶液属于饱和溶液的是_____。
(2)下列关于①~⑤所得溶液的说法不正确的是_____。
A.溶质质量:①<②B.溶液质量:②<④
C.溶质质量分数:①=③D.⑤中溶质与溶剂的质量比为9:10
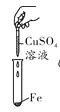
【题目】小杰同学在复习铁生锈条件时知道,常温下,没有氧气,铁与水几乎不反应。老师告诉同学们,高温下,铁与水蒸气能反应生成一种常见的铁的氧化物和一种气体。小杰很好奇,设计如图所示实验探究铁粉与水蒸气反应后的产物。
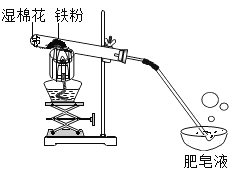
(1)试管尾部放一团湿棉花的目的是___________________。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________________。
(3)探究试管中剩余固体成分是什么?
(查阅资料)常见的铁的氧化物有FeO(黑色、没有磁性)、![]() 、
、![]() 。
。
(初步验证)试管中固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是![]() ;猜想二剩余固体是__________________。
;猜想二剩余固体是__________________。
(实验探究)
实验操作 | 实验现象结论 |
______________________ | ___________________证明猜想一正确 |
(实验结论)铁和水蒸气反应的化学方程式:___________________。
(反思与交流)该黑色固体不可能是![]() ,理由是___________________。
,理由是___________________。