题目内容
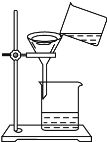
【题目】氢化钙(CaH2)是有机合成的还原剂,遇水发生化学反应,生成氢氧化钙和氢气.为了测定某样品中氢化钙的含量,进行了如图所示实验,请计算: 
(反应原理:CaH2+2H2O═Ca(OH)2+2H2↑)
(1)生成氢气的质量是g.
(2)该样品中氢化钙的质量分数(要求写出计算过程).
【答案】
(1)1.6
(2)解:根据质量守恒定律可求,生成氢气的质量为20g+30g﹣48.4g=1.6g
设氢化钙的质量为x
CaH2+2H2O═Ca(OH)2+ | 2H2↑ |
42 | 4 |
x | 1.6g |
![]() =
= ![]()
x=16.8g
该样品中氢化钙的质量分数为 ![]() ×100%=84%
×100%=84%
答:该样品中氢化钙的质量分数84%
【解析】解: 根据质量守恒定律可求,生成氢气的质量为20g+30g﹣48.4g=1.6g
设氢化钙的质量为x
CaH2+2H2O═Ca(OH)2+ | 2H2↑ |
42 | 4 |
x | 1.6g |
![]() =
= ![]()
x=16.8g
该样品中氢化钙的质量分数为 ![]() ×100%=84%
×100%=84%
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
相关题目
【题目】如表是氯化钠和硝酸钾在不同温度下的溶解度,请回答
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,100g水中最多可以溶解g氯化钠.
(2)要使接近饱和的硝酸钾溶液变为饱和溶液,可采取的方法是(写1种).
(3)60℃时,KNO3饱和溶液的溶质质量分数为(精确到0.1%).
(4)请在如图坐标系中,用光滑的曲线绘制硝酸钾的溶解度曲线.