题目内容
【题目】白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程。(部分反应产物在图中已略去)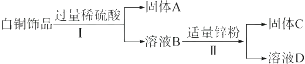
已知溶液B中含有一种二价金属的硫酸化合物,溶液D中只有一种溶质。
分析该流程,回答下列问题:
(1)固体A的化学式为 , 过程Ⅱ中的实验操作名称是。
(2)过程Ⅰ中反应的化学方程式为。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是。
【答案】
(1)Cu,过滤
(2)Ni+H2SO4=NiSO4+H2↑
(3)Zn、Ni、Cu
【解析】根据金属的活泼性顺序:铜在氢的后面与酸不反应,可知白铜饰品中加入过量的稀硫酸,镍可以与硫酸反应,已知溶液B中含有一种二价金属硫酸盐,故反应的化学方程式为:Ni+H2SO4=NiSO4+H2↑;溶液B为硫酸镍和稀硫酸的混合物,再加入适量的锌粉,因为溶液D中只有一种溶质,所以是锌与硫酸反应生成硫酸锌和氢气,锌与硫酸镍反应生成硫酸锌和镍,说明锌比镍活泼,所以
(1)由以上分析可知:固体A的化学式为Cu,过程Ⅱ中的实验操作名称是过滤,所用到的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)过程Ⅰ中的反应是镍和硫酸反应生成硫酸镍和氢气,化学方程式为:Ni+H2SO4=NiSO4+H2↑;
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是:Zn、Ni、Cu.
故答案为:(1)Cu;过滤;(2)Ni+H2SO4=NiSO4+H2↑;(3)Zn、Ni、Cu.
金属能与酸反应的排在氢前面,不能与酸反应的排在氢的后面,活泼的金属能把不活泼的金属从盐溶液中置换出来.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)