题目内容
有一无色溶液含有CuSO4、HCl、BaCl2、Ba(OH)2、NaOH、NaCl、Na2CO3中的某两种,作如下实验:1测得溶液的pH=14;
②向溶液中加入Na2SO4有沉淀生成.沉淀的名称是,溶液中含有的两种溶质的可能组合是(至少写出三种组合,多写且正确加1分)
①;②;
③;④.
【答案】分析:可以根据物质之间相互作用的情况进行分析、判断.例如,测得溶液的pH=14,说明溶液显碱性.加入硫酸钠时有沉淀生成,说明溶液中含有钡离子.
解答:解:由于无色,且显碱性,所以一定不含硫酸铜和盐酸,一定含有氢氧化钠.由于碳酸钠碱性较弱,所以不能因为显碱性就说存在碳酸钠.
加入硫酸钠时生成沉淀,分析以上物质可知,只有氯化钡或氢氧化钡能和硫酸钠反应生成沉淀硫酸钡.故填:硫酸钡.既然是含有钡离子,所以一定不能同时含有碳酸钠.故混合物一定无碳酸钠.
Ba(OH)2和BaCl2组合时显碱性,能和硫酸钠反应生成沉淀.
Ba(OH)2和NaOH组合时显碱性,能和硫酸钠反应生成沉淀.
Ba(OH)2和NaCl组合时显碱性,能和硫酸钠反应生成沉淀.
BaCl2和NaOH组合时显碱性,能和硫酸钠反应生成沉淀.
故填:Ba(OH)2和BaCl2Ba(OH)2和NaOH、Ba(OH)2和NaCl、BaCl2和NaOH.
点评:本题主要考查了物质之间相互作用时的反应现象及其应用等方面的问题.
解答:解:由于无色,且显碱性,所以一定不含硫酸铜和盐酸,一定含有氢氧化钠.由于碳酸钠碱性较弱,所以不能因为显碱性就说存在碳酸钠.
加入硫酸钠时生成沉淀,分析以上物质可知,只有氯化钡或氢氧化钡能和硫酸钠反应生成沉淀硫酸钡.故填:硫酸钡.既然是含有钡离子,所以一定不能同时含有碳酸钠.故混合物一定无碳酸钠.
Ba(OH)2和BaCl2组合时显碱性,能和硫酸钠反应生成沉淀.
Ba(OH)2和NaOH组合时显碱性,能和硫酸钠反应生成沉淀.
Ba(OH)2和NaCl组合时显碱性,能和硫酸钠反应生成沉淀.
BaCl2和NaOH组合时显碱性,能和硫酸钠反应生成沉淀.
故填:Ba(OH)2和BaCl2Ba(OH)2和NaOH、Ba(OH)2和NaCl、BaCl2和NaOH.
点评:本题主要考查了物质之间相互作用时的反应现象及其应用等方面的问题.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目

 27、某兴趣小组在探究金属与酸的反应时发现了意外情况:铜能与稀硫酸反应--将一小块铜片放入试管中,加入适量稀硫酸,无现象;加热该试管,较长时间后铜片上有气泡,溶液逐渐变成了蓝色.
27、某兴趣小组在探究金属与酸的反应时发现了意外情况:铜能与稀硫酸反应--将一小块铜片放入试管中,加入适量稀硫酸,无现象;加热该试管,较长时间后铜片上有气泡,溶液逐渐变成了蓝色.
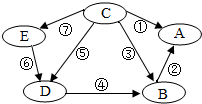 (2013?广东模拟)A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质之间的转化关系.其中,A为食盐的主要成分,B中含钡元素,D,E为有颜色的溶液,其他物质的溶液都为无色;⑤和⑥为置换反应,其他均为复分解反应.
(2013?广东模拟)A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质之间的转化关系.其中,A为食盐的主要成分,B中含钡元素,D,E为有颜色的溶液,其他物质的溶液都为无色;⑤和⑥为置换反应,其他均为复分解反应.