题目内容
先在表中空白处填写相关的内容,再根据表中提供的信息研究下面的问题.
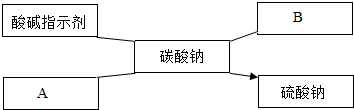
由蒸发海水制得的食盐中,常含有Na2SO4、CaCl2等杂质,这些杂质对后继生产有害,需要除去.问:
(1)Na2SO4和CaCl2在溶液里能形成Na+、SO42-、Ca2+和Cl-四种离子.要除去其中的Ca2+,可使用 溶液;除去其中的SO42-,可使用 溶液.
(2)在工业生产的除杂过程中,又会带进CO32-和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的 ,并用 测定溶液的酸碱性.
| 反应物I | 反应物Ⅱ | 反应现象 | 说 明 |
| AgNO3溶液 | NaCl溶液 | 生成白色沉淀 | 该沉淀为AgCl,不溶于稀H NO3 |
| BaCl2溶液 | Na2SO4溶液 | 生成白色沉淀 | 该沉淀为BaSO4,不溶于稀HCl |
| Na2CO3溶液 | 生成白色沉淀 | 该沉淀为 |
(1)Na2SO4和CaCl2在溶液里能形成Na+、SO42-、Ca2+和Cl-四种离子.要除去其中的Ca2+,可使用
(2)在工业生产的除杂过程中,又会带进CO32-和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的
考点:盐的化学性质,溶液的酸碱性测定
专题:常见的盐 化学肥料
分析:根据复分解发生的条件和物质的溶解性分析:
(1)钙离子和碳酸根离子能结合成沉淀,硫酸根和钡离子能结合成沉淀;
(2)碳酸根和氢氧根都能和氢离子反应,测定溶液的酸碱性可用pH试纸.
(1)钙离子和碳酸根离子能结合成沉淀,硫酸根和钡离子能结合成沉淀;
(2)碳酸根和氢氧根都能和氢离子反应,测定溶液的酸碱性可用pH试纸.
解答:解:碳酸钠溶液中的碳酸根离子能和含有钙离子的溶液反应生成碳酸钙沉淀,
故答案为:CaCl2(氯化钙)溶液、Ca(OH)2(氢氧化钙)溶液、可溶性钙盐等;CaCO3(碳酸钙)等;
(1)要除去其中溶液中的Ca2+,可使用含有碳酸根离子的溶液,如 Na2CO3溶液等;除去其中溶液中的SO42-,可使用含钡离子的溶液,如 BaCl2溶液.故答案为:Na2CO3(或碳酸钠) BaCl2(或氯化钡);
(2)要同时除去CO32-和OH-这两种离子,最简便的方法是加入适量的稀盐酸,碳酸根和酸反应生成二氧化碳和水,氢氧根和酸反应生成水,反应后可用 pH试纸测定溶液的酸碱性.故答案为:稀盐酸(或稀HCl);pH试纸(或pH计等).
故答案为:CaCl2(氯化钙)溶液、Ca(OH)2(氢氧化钙)溶液、可溶性钙盐等;CaCO3(碳酸钙)等;
(1)要除去其中溶液中的Ca2+,可使用含有碳酸根离子的溶液,如 Na2CO3溶液等;除去其中溶液中的SO42-,可使用含钡离子的溶液,如 BaCl2溶液.故答案为:Na2CO3(或碳酸钠) BaCl2(或氯化钡);
(2)要同时除去CO32-和OH-这两种离子,最简便的方法是加入适量的稀盐酸,碳酸根和酸反应生成二氧化碳和水,氢氧根和酸反应生成水,反应后可用 pH试纸测定溶液的酸碱性.故答案为:稀盐酸(或稀HCl);pH试纸(或pH计等).
点评:此题考查了初中化学中常见的不溶性物质和离子之间的反应,这也是判断复分解反应的重要条件,所以要熟练掌握物质的溶解性和离子间的反应规律.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
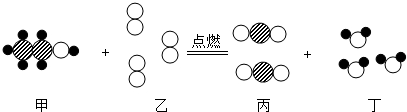
如图为某化学反应的微观模拟图,其中“ ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子.则下列说法不正确的是( )
”表示氢原子.则下列说法不正确的是( )
 ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子.则下列说法不正确的是( )
”表示氢原子.则下列说法不正确的是( )
| A、化学反应前后原子的数目发生了改变 |
| B、反应物甲、乙两种分子的个数比为1:3 |
| C、甲物质中碳、氧元素的质量比为3:2 |
| D、生成物丙和丁都是氧化物 |
 (1)用适当的化学符号表示:
(1)用适当的化学符号表示: