题目内容
【题目】向25gMgCl2和HCl的混合溶液中,逐滴加入10%的氢氧化钠溶液,反应情况如图所示: 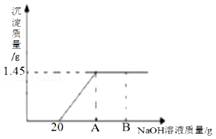
(1)当滴加氢氧化钠溶液的质量至B点时所得溶液的pH值为(填编号)
A.大于7
B.等于7
C.小于7
(2)通过计算,确定A点的值(请写出计算过程).
【答案】
(1)A
(2)解:设与氯化镁反应的氢氧化钠的质量为x,
MgCl2+ | 2NaOH═2NaCl+ | Mg(OH)2↓ |
80 | 58 | |
x | 1.45g |
![]() =
= ![]() ,
,
x=2g,
与氯化镁反应的氢氧化钠溶液的质量为:2g÷10%=20g,
A点时氢氧化钠溶液质量为:20g+20g═40g,
答:A点的值是40.
【解析】解:(1)当滴加氢氧化钠溶液的质量至B点时,氢氧化钠溶液过量,所得溶液显碱性,溶液的pH值大于7. 故选:A.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目
