题目内容
 氢氧化钠是一种重要的化工原料.
氢氧化钠是一种重要的化工原料.(1)氢氧化钠俗称
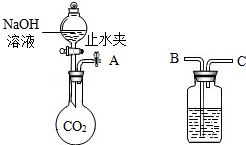
(2)利用如图所示装置(固定装置省略)进行NaOH与CO2气体反应的实验.若A与C连接,将分液漏斗中部分NaOH溶液注入烧瓶中,然后关闭活塞并打开止水夹,观察到的实验现象是
(3)已知:Na2CO3+H2O+CO2=2NaHCO3; NaHCO3+NaOH=Na2CO3+H2O
将(2)中实验后烧瓶内的溶液在低温下蒸干得到白色固体X,则X的组成可能有四种情况,分别是:
Ⅰ.NaOH,Na2CO3;Ⅱ.
(4)根据以上信息,请设计一种以100mL未知浓度的NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法
考点:碱的化学性质,常见碱的特性和用途,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的碱 碱的通性
分析:(1)氢氧化钠俗称火碱、烧碱、苛性钠;
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水,二氧化碳被消耗后,会导致烧瓶中的压强减小;
(3)二氧化碳和氢氧化钠反应时,如果氢氧化钠过量,则溶质是氢氧化钠和碳酸钠;
如果二氧化碳过量,但是不能完全消耗生成的碳酸钠,则溶质是碳酸钠和碳酸氢钠;
如果氢氧化钠和二氧化碳恰好完全反应,则溶质是碳酸钠;
如果二氧化碳过量,并且把碳酸钠完全消耗,则溶质是碳酸氢钠;
(4)根据提供的信息可以判断利用NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法.
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水,二氧化碳被消耗后,会导致烧瓶中的压强减小;
(3)二氧化碳和氢氧化钠反应时,如果氢氧化钠过量,则溶质是氢氧化钠和碳酸钠;
如果二氧化碳过量,但是不能完全消耗生成的碳酸钠,则溶质是碳酸钠和碳酸氢钠;
如果氢氧化钠和二氧化碳恰好完全反应,则溶质是碳酸钠;
如果二氧化碳过量,并且把碳酸钠完全消耗,则溶质是碳酸氢钠;
(4)根据提供的信息可以判断利用NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法.
解答:解:(1)氢氧化钠俗称火碱、烧碱、苛性钠.
故填:火碱、烧碱、苛性钠.
(2)若A与C连接,将分液漏斗中部分NaOH溶液注入烧瓶中,然后关闭活塞并打开止水夹,由于二氧化碳被消耗后,会导致烧瓶中的压强减小,空气会通过B进入洗气瓶中,通过C进入烧瓶,因此能够观察到B导管口产生气泡;
CO2与NaOH溶液反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O.
故填:B导管口产生气泡;2NaOH+CO2═Na2CO3+H2O.
(3)二氧化碳和氢氧化钠反应时,如果氢氧化钠过量,则溶质是氢氧化钠和碳酸钠;
如果二氧化碳过量,但是不能完全消耗生成的碳酸钠,则溶质是碳酸钠和碳酸氢钠;
如果氢氧化钠和二氧化碳恰好完全反应,则溶质是碳酸钠;
如果二氧化碳过量,并且把碳酸钠完全消耗,则溶质是碳酸氢钠.
故填:Na2CO3、NaHCO3;Na2CO3.
(4)以100mL未知浓度的NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法是:先向100mL氢氧化钠溶液中通入过量的二氧化碳,再取100mL相同浓度的氢氧化钠溶液和生成的碳酸氢钠溶液混合.
故填:先向100mL氢氧化钠溶液中通入过量的二氧化碳,再取100mL相同浓度的氢氧化钠溶液和生成的碳酸氢钠溶液混合.
故填:火碱、烧碱、苛性钠.
(2)若A与C连接,将分液漏斗中部分NaOH溶液注入烧瓶中,然后关闭活塞并打开止水夹,由于二氧化碳被消耗后,会导致烧瓶中的压强减小,空气会通过B进入洗气瓶中,通过C进入烧瓶,因此能够观察到B导管口产生气泡;
CO2与NaOH溶液反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O.
故填:B导管口产生气泡;2NaOH+CO2═Na2CO3+H2O.
(3)二氧化碳和氢氧化钠反应时,如果氢氧化钠过量,则溶质是氢氧化钠和碳酸钠;
如果二氧化碳过量,但是不能完全消耗生成的碳酸钠,则溶质是碳酸钠和碳酸氢钠;
如果氢氧化钠和二氧化碳恰好完全反应,则溶质是碳酸钠;
如果二氧化碳过量,并且把碳酸钠完全消耗,则溶质是碳酸氢钠.
故填:Na2CO3、NaHCO3;Na2CO3.
(4)以100mL未知浓度的NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法是:先向100mL氢氧化钠溶液中通入过量的二氧化碳,再取100mL相同浓度的氢氧化钠溶液和生成的碳酸氢钠溶液混合.
故填:先向100mL氢氧化钠溶液中通入过量的二氧化碳,再取100mL相同浓度的氢氧化钠溶液和生成的碳酸氢钠溶液混合.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
某物质在氧气中燃烧只生成CO2和H2O,且它们的质量比为11:9,则此物质可能是( )
| A、C2H5OH |
| B、C2H4 |
| C、C2H6 |
| D、CH3OH |