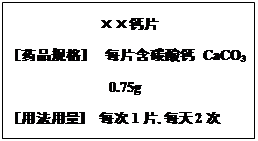题目内容
22 g氯化镁、氯化钙和氯化钠组成的混合物中,含有镁元素1.2g,钙元素2g,混合物中钠元素与氯元素的质量比为
| A.23﹕35.5 | B.23﹕71 | C.23﹕142 | D.46﹕213 |
B
试题分析:根据物质中某元素的质量分数计算方法,由镁元素的质量求出氯化镁的质量,进而可求氯化镁中氯元素的质量;同理可求出氯化钙的质量和氯化钙中氯元素的质量;根据混合物总质量求出氯化钠的质量,然后分别求出氯化钠中氯元素和钠元素的质量;把三部分的氯元素质量相加就是混合物中氯元素的质量,再和钠元素相比就可求出答案。
解:混合物中氯化镁的质量为1.2g÷(
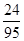 ×100%)=4.75g,
×100%)=4.75g,则氯化镁中氯元素的质量为4.75g×
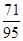 ×100%=3.55g;
×100%=3.55g;混合物中氯化钙的质量为2g÷(
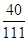 ×100%)=5.55g,
×100%)=5.55g, 则氯化钙中氯元素的质量为5.55g×
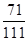 ×100%=3.55g;
×100%=3.55g;所以,混合物中氯化钠的质量为22g-4.75g-5.55g=11.7g,
则氯化钠中氯元素的质量为11.7g×
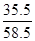 ×100%=7.1g,
×100%=7.1g,钠元素的质量为:11.7g-7.1g=4.6g;
所以混合物中氯元素的质量为3.55g+3.55g+7.1g=14.2g,
则混合物中钠元素与氯元素的质量比=4.6g:14.2g=23:71。故选B
点评:本题考查学生根据物质中某元素的质量分数进行综合分析解题的能力,熟练掌握元素的质量分数计算是解题的关键,在平时的学习中要注意多训练。

练习册系列答案
相关题目