题目内容
【题目】由我国化工专家侯德榜探索发明的“侯氏制碱法”,其生产过程涉及的主要化学反应如下:①NH3+CO2+X=NH4HCO3 ②NH4HCO3+NaCl(饱和)==NH4Cl+NaHCO3 ↓ ③2NaHCO3![]() Na2CO3+H2O+CO2 ↑ 请回答:
Na2CO3+H2O+CO2 ↑ 请回答:
(1)反应①中X的化学式为___________________;
(2)反应②属于基本类型中的____________________反应。
(3)除去混在Na2CO3粉末中少量的NaHCO3的方法是______________________。
【答案】 H20 复分解反应 充分加热
【解析】(1)反应①中生成物中的氮、氢、碳、氧的原子个数分别为1、5、1、3,反应物中的氮、氢、碳、氧的原子个数分别为1、3、1、2,所以X中含有2个氢原子和1个氧原子,故X的化学式为H20;
(2)反应②是由化合物与化合物互相交换成分生成了新的化合物与化合物,故符合复分解反应的定义,故是复分解反应;
(3)碳酸钠受热不易分解,碳酸氢钠受热易分解生成碳酸钠和二氧化碳和水,加热后可以除去碳酸氢钠,且不生成杂质,故除去混在Na2CO3粉末中少量的NaHCO3的方法是充分加热;

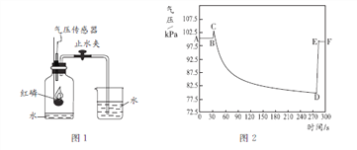
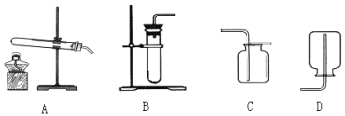
【题目】某化学兴趣小组的同学利用下图装置制取并收集一瓶二氧化碳气体,请和他们一起完成以下实验探究。
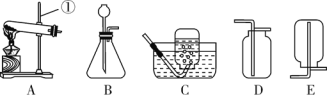
(1)写出标号①的仪器名称________。
(2)实验室制取一瓶二氧化碳气体,应选用的收集装置为________(填序号),反应的化学方程式为____________________。
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究。
(提出问题)废液中的溶质有哪些物质?
(查阅资料)氯化钙溶液呈中性。
(猜想与假设)猜想①:废液中的溶质只有氯化钙;
猜想②:废液中的溶质是氯化钙和________(填化学式)。
(设计并进行实验)Ⅰ. 为验证上面两种猜想哪种正确,甲小组的同学从下面A~E五种药品中选择合适的一种进行实验,证明了猜想②是正确的。他们选择的药品不可能是________。
A. 紫色石蕊试液 B. 无色酚酞试液 C. 锌粒 D. 氧化铁粉末 E. 氢氧化钠溶液
Ⅱ. 乙小组选用一种钠盐溶液进行实验,也证明了猜想②是正确的,请完成下面的实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量反应后的废液于试管中,加入足量___________(填化学式)溶液,振荡 | _______________ | 猜想②正确 |
(探究反思):实验产生的污染深受人们重视,我们要利用恰当的方法对废液进行处理,实行无害化排放,从源头上消除对环境的污染。
(4)使用纯碱中常含有少量的氯化钠,现取某使用纯碱样品2.5g,加水溶解,配成溶液,向其中加入一定量CaCl2溶液恰好完全反应,同时产生了2g沉淀。试计算该食用纯碱中Na2CO3的质量分数_____________(写出计算过程)。