题目内容
甲、乙、丙三种固体物质,具有下列性质:甲适宜用蒸发溶剂的方法从溶液中析出,乙最适宜重结晶(即多次结晶)法提纯。一定量的丙在相同质量的热水和冷水中能配制成饱和溶液和不饱和溶液。试根据如图回答下列问题:
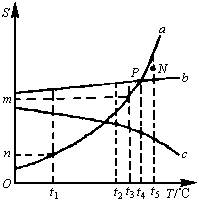
(1)甲、乙、丙三种物质对应的溶解度曲线分别是________(填a、b、c)。
(2)在t5℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是________。
(3)P点表示的意义是________,此时,两物质饱和溶液的溶质质量分数________。(填相等、不相等、不能确定)
(4)N点表示该温度下,甲是________溶液,乙是________溶液。若将该条件下乙的不饱和溶液变为饱和溶液,可选用具体的方法有①________;②________;③________。
(5)在t1℃时,三只烧杯各盛有50g水,分别溶解甲、乙、丙三种物质,溶解得最多的是________;溶解得最少的是________。
(6)在t2℃时,取甲、乙、丙三种物质各10g分别制成饱和溶液,所需水最多的物质是________,需水量少的是________。
(7)在t3℃时,有乙的饱和溶液Wg,其中含乙物质有________g;当温度降低到t1℃时,能析出乙的结晶(不含结晶水)________g。
解析:
| 精析 这是一道溶解度曲线综合应用题,主要考查溶解度的知识,识图能力及抽象思维能力。解答时须审清题意,抓住物质的结晶方法以及溶解度与温度的关系。
(1)题设甲适宜用蒸发溶剂的方法从溶液中析出,证明甲的溶解度受温度影响不大,曲线较平坦,因此,可判断b是甲物质的溶解度曲线。乙适宜用从溶液中多次结晶的方法提纯,说明乙的溶解度随温度升高增大较快,曲线较陡,因此,可判断a是乙物质的溶解度曲线。显然,剩下的c就是丙物质的溶解度曲线[等量的丙在等量的溶剂中,高温(热水)时形成饱和溶液,低温(冷水)时形成不饱和溶液,说明丙的溶解度随温度升高反而减小]。 (2)可直接比较同一温度(t5℃)时三种物质的溶解度(S)的大小S丙<S甲<S乙。 (3)P点是甲、乙两物质溶解度曲线的交点,表示甲、乙两物质在t4℃时的溶解度相同。亦说明该温度下,100g水中分别溶解甲、乙两物质达到饱和时,其质量相等。故此时饱和溶液中溶质的质量分数仍相等。 (4)N点是曲线外的点,界于甲的曲线b之上,乙的曲线a之下。根据前面的总结,曲线上方、下方的点所对应的温度和溶质配制的溶液分别是饱和溶液和不饱和溶液。所以,N点表示在t5℃时甲的饱和溶液、乙的不饱和溶液。由于乙的溶解度随温度升高增大较快,所以,该温度下乙的不饱和溶液要达到饱和时,可采取①增加溶质(乙);②降低温度;③蒸发溶剂。 (5)当温度相同,溶剂质量相等时,溶解得最多的是溶解度最大的物质;反之亦然。故t1℃时,50g水中溶解最多的是甲,最少的是乙。 (6)当温度相同,溶质质量相等,制成饱和溶液时,所需溶剂最少的是溶解度最大的物质;反之亦然。故t2℃时,三种物质各10g刚好溶解时,需水最少的是甲,需水最多的是丙。 (7)从曲线图可以看出,乙的溶解度在t1℃时为ng,t3℃时为mg。 t3℃时的Wg该饱和溶液中含溶质乙有: 假设这些水在t1℃时能溶解xg乙物质,则
当温度从t3℃降到t1℃能析出乙物质结晶
亦可这样理解,根据溶解度曲线可知,当t2℃时,(100+m)g乙的饱和溶液,降温到t1℃时,得乙的饱和溶液(100+n)g,析出乙的晶体为(m-n)g。所以,当Wgt3℃时的该饱和溶液降温至t1℃时,会析出乙的晶体W´ 答案 (1)b、a、c (2)丙、甲、乙 (3)甲、乙在t4时溶解度相同 相等 (4)饱和 不饱和 增加溶质 降温 蒸发溶剂 (5)甲 乙 (6)丙 甲 (7)
|
提示:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案