题目内容
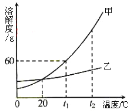
【题目】铁制品锈蚀的过程,实际上是铁与空气中的 等发生化学反应的过程,铁锈的主要成分是Fe2O3 xH2O。某化学兴趣小组在实验室中用足量一氧化碳还原铁锈,装置如右图,酒精灯b的作用是 。
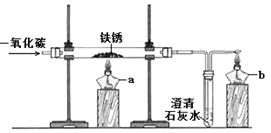
【现象分析】实验过程中,观察到玻璃管中固体 ,澄清石灰水变浑浊,证明一氧化碳还原了铁锈。
【提出问题】一氧化碳还原铁锈的固体产物是铁吗?
【实验设计】上述反应进行完全后,冷却到室温,取少量玻璃管中的固体,加入稀盐酸,若观察到 ,则证明有铁生成。该小组同学按上述设计进行实验,并未观察到预期现象。
【查阅资料】一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关,可能生成四氧化三铁、氧化亚铁、铁。
【实验反思】一氧化碳还原铁锈的实验中,若要得到铁可适当提高反应温度和延长反应时间。上图所示实验装置中,应作的一处修改是 。
【重新实验】该小组同学用修改后的装置重新进行实验,完全反应后,冷却到室温,取少量玻璃管中的固体,加入硫酸铜溶液,观察到 ,证明有铁生成。
【拓展应用】该小组同学用修改后的装置进行一氧化碳还原赤铁矿的实验,使赤铁矿中的氧化铁全部转变为铁(已知赤铁矿中的杂质不与一氧化碳反应),测得下列数据:
①反应前玻璃管和内盛赤铁矿粉末的总质量70.0g(玻璃管的质量为60.0g);
②反应后玻璃管和内盛固体的总质量67.6g(冷却到室温称量)。
则该赤铁矿中氧化铁的质量分数为 。
【答案】氧气、水蒸气(或O2、H2O) 点燃多余的一氧化碳,防止污染空气
【现象分析】由红色变为黑色 【实验设计】有气泡产生
【实验反思】将酒精灯a换成酒精喷灯(或给酒精灯a加网罩)
【重新实验】有红色固体析出 【拓展应用】80%
【解析】
试题分析:铁的生锈是铁与空气中的氧气和水蒸气发生的化学反应;一氧化碳不可能完全反应,直接排放到空气中会造成污染,因此需要进行尾气出理,点燃使其燃烧生成CO2;【现象分析】由红色氧化铁变为黑色铁;【实验设计】铁与盐酸反应会有氢气生成,有气泡,而氧化铁和碳则不会;【实验反思】适当提高温度,可以酒精灯a换成酒精喷灯;【重新实验】铁与硫酸铜发生置换反应生成铜和硫酸亚铁,固体由黑色的铁变成红色的铜,溶液由蓝色的硫酸铜变为浅绿色的硫酸亚铁;【拓展应用】由3CO+2Fe2O3![]() 2Fe+3CO2,固体由Fe2O3变为Fe,因此固体质量的减少即为氧化铁中氧元素的质量,m(O)=70.0g-67.6g=2.4g,m(Fe2O3)=2.4g÷(160/48)=8g,Fe2O3%=8g÷(70g-60g)×100%=80%。
2Fe+3CO2,固体由Fe2O3变为Fe,因此固体质量的减少即为氧化铁中氧元素的质量,m(O)=70.0g-67.6g=2.4g,m(Fe2O3)=2.4g÷(160/48)=8g,Fe2O3%=8g÷(70g-60g)×100%=80%。

 53天天练系列答案
53天天练系列答案