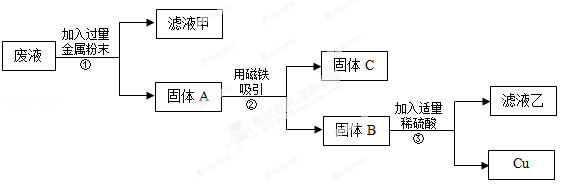
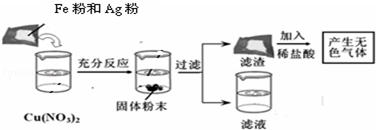
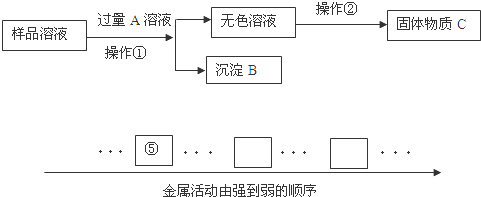
题目内容
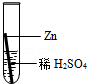
向一定质量的稀硫酸中加入过量锌粉,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑。下列图象合理的是
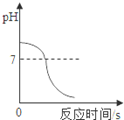

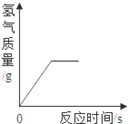
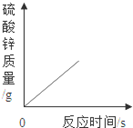
A B C D




A B C D
A
试题分析:锌粒和稀硫酸反应生成硫酸锌和氢气,随着反应的进行,酸性溶液变成中性溶液,硫酸锌和氢气的质量会越来越多直至不再发生变化。A、由于是稀硫酸变成了硫酸锌溶液,溶液由酸性变成中性,故A错误;B、由于是每向溶液中加入65份质量的锌粒只会生成2份质量的氢气扩散出来,所以,溶液的质量增加,但是反应的起点应该在纵轴上,不应该在原点,故B不正确;C、随着反应的进行,生成的氢气会越来越多直至不再增加,故C正确;D、随着反应的进行,生成的硫酸锌会越来越多直至不再增加,故D错误,故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目