题目内容
【题目】除去 CO 中少量 CO2,可采用的方法是( )
A.通过灼热氧化铜B.倾倒混合气体
C.通入澄清的石灰水D.把混合气体点燃
【答案】C
【解析】
A、将气体通过灼热的氧化铜,CO 与氧化铜反应生成 CO2,没有除 去 CO2 却把 CO 完全除去,不符合题意;
B、二者都是气体,利用倾倒不能将二者分离,不符合题意;
C、将气体通过石灰水,CO2 与氢氧化钙反应而被吸收,可除去 CO 中混有的少量 CO2 气体;且该方案简便易操作,符合题意;
D、二氧化碳不能被点燃,不符合题意。
故选C。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】人体中几种体液的正常pH 范围如下表,所列体液中碱性最强的是
唾 液 | 胃 液 | 血 液 | 小 肠 液 | 胆 汁 |
6.6~7.1 | 0.9~1.5 | 7.35~7.45 | 7.6 | 7.1~7.3 |
A.唾液B.血液C.胆汁D.小肠液
【题目】探究(1):碳酸氢钠(NaHCO3)俗名小苏打,常用于食品和医学工业.某化学兴趣小组的同学对碳酸氢钠进行加热,发现有气泡,同时还剩余白色固体.他们对白色固体进行探究.
【提出问题】这白色固体是什么?
【查阅资料】碳酸氢钠受热易分解生成水、二氧化碳和一种常见的固体.
【提出猜想】
猜想1:白色固体是碳酸钠,
猜想2:白色固体是氢氧化钠
猜想3:白色固体是氢氧化钠和碳酸钠的混合物
【实验探究】
(1)兴趣小组为了确定反应后的固体产物成分,进行了如下实验,请填写下表:
实验方案 | 实验现象 | 结论 |
步骤一:取少量反应后的固体产物溶于水,加入过量的中性氯化钙溶液,过滤. | 产生白色沉淀 | 猜想1成立 |
步骤二:取滤液少许,往滤液中滴入:①________________ | ②_____________ |
【实验总结】写出碳酸氢钠受热分解的化学方程式③______________ .
(2)探究2:某化学兴趣小组把金属钠投到硫酸铜溶液中,实验并非如想象的有红色铜析出,而是生成一种蓝色沉淀.同学们非常好奇并进行实验探究.
【提出问题】金属钠投到硫酸铜溶液中到底发生了怎样的化学反应?
【查阅资料】钠是非常活泼的金属,能与水发生剧烈反应,并放出气体,生成的溶液显碱性
【提出猜想】
猜想1:钠先与水反应生成氢气和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
猜想2:钠先与水反应生成某气体和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
【实验探究】
实验一:同学们把一小块切干净的钠投到装有少量蒸馏水的试管中,点燃生成的气体,听到“噗”的一声后燃烧起来;
实验二:在剩余的溶液中加入硫酸铜溶液,发现有蓝色沉淀.
【实验总结】
①两个猜想中的“某碱”是_____________ , 猜想2中生成的气体是_______________________________;
②水与金属钠反应的化学方程式_______________________________________________ .
③请你判断猜想_________________________________成立.
【题目】已知氯化钠和硝酸钾的溶解度如表:
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,氯化钠饱和溶液的溶质质量分数是_________________%.
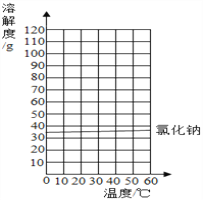
(2)请在如图中画出KNO3的溶解度曲线:图中两溶解度曲线交点的意义是________________
(3)KNO3是化学肥料中的___肥料,从热的KNO3浓溶液中析出晶体的方法是________________________ .
