题目内容
(2009?赤峰)某实验小组的同学在完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不含其它的杂质)进行如下实验:取一定量该混合溶液放入烧杯中,再滴入20g溶质质量分数为10.6%的碳酸钠溶液.滴入碳酸钠溶液的质量与生成沉淀的质量的关系如图所示.求:所取混合液中HCl和CaCl2的质量.

【答案】分析:所加入的碳酸钠溶液首先与混合溶液中的盐酸发生反应,待盐酸完全反应后继续和氯化钙进行反应;由变化曲线图可知,所加入的碳酸钠溶液有5g与盐酸发生反应、10g与氯化钙溶液发生反应;根据反应的化学方程式,由碳酸钠的质量分别计算出盐酸与氯化钙的质量.
解答:解:设所取混合溶液中含HCl的氯化钙的质量分别为x和y
2HCl+Na2CO3═2NaCl+CO2↑+H2O
73 106
x 5g×10.6%
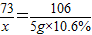
x=0.365g
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106
y (15-5)g×10.6%
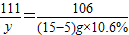
y=1.11g
答:所取混合液中HCl和CaCl2的质量分别为0.365g和1.11g.
点评:变化曲线的起点是前一个反应恰好完全反应的终点也是后一个反应的起点,曲线折点则是与此曲线相关反应的终点.
解答:解:设所取混合溶液中含HCl的氯化钙的质量分别为x和y
2HCl+Na2CO3═2NaCl+CO2↑+H2O
73 106
x 5g×10.6%
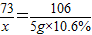
x=0.365g
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106
y (15-5)g×10.6%
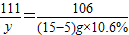
y=1.11g
答:所取混合液中HCl和CaCl2的质量分别为0.365g和1.11g.
点评:变化曲线的起点是前一个反应恰好完全反应的终点也是后一个反应的起点,曲线折点则是与此曲线相关反应的终点.

练习册系列答案
相关题目