题目内容
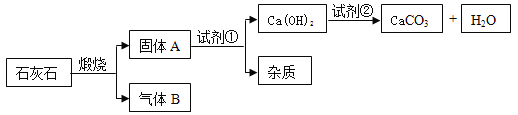
【题目】某工厂欲从溶质只含有硫酸铜的废液中回收金属铜,并得到工厂原料硫酸亚铁晶体,其流程如下,
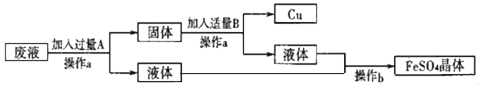
(1)操作a的名称是______________
(2)A是_______,加入过量A的目的是______________;B是_________,上述过程中有关反应的化学方程式___________、_________。
【答案】过滤 铁 将废液中的铜全部转化为铜单质 稀硫酸 Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑
【解析】
(1)由图示可以看出操作a将溶液和固体进行了分离,因此操作的名称为过滤,故填过滤。
(2)由于活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,所以根据铁的活动性比铜强,可知铁会置换出硫酸铜中的铜,所以A为铁,故填铁;
加入过量的铁能将废液中的铜全部转化为铜单质,故填将废液中的铜全部转化为铜单质;
操作a后的固体中含有铁和铜,可向该固体中加入稀硫酸,将铁转化为硫酸亚铁,而铜与稀硫酸不反应,故填稀硫酸;
上述流程中的反应有:铁与硫酸铜反应生成硫酸亚铁和铜,稀硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式写为:Fe+CuSO4=FeSO4+Cu,Fe+H2SO4=FeSO4+H2↑,故填Fe+CuSO4=FeSO4+Cu和Fe+H2SO4=FeSO4+H2↑。

【题目】为探究某塑料的组成元素,设计了实验 I 和 II。回答下列问题:
I.制取氧气
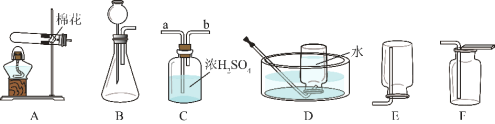
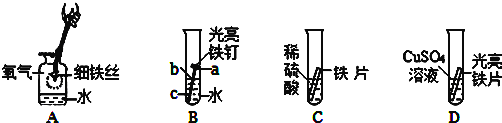
(1)若用一种暗紫色固体制取 O2,发生反应的化学方程式为_____,发生装置应选择上述装置_____(填标号)。
(2)欲制取干燥的 O2,装置合理的连接顺序为:发生装置→C→_____(填标号)。连接装置时,发生装置的出气口应与装置 C 中_____(填“a”或“b”)端相连。
II.组成探究
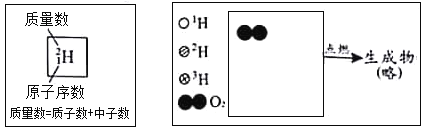
(3)定性检测(已知:无水 CuSO4 遇水变蓝色)
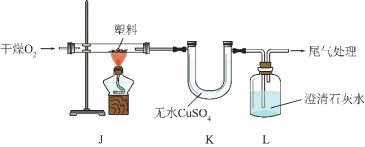
实验操作 | 实验现象 | 结论 |
连接装置,检查气密性,装入试剂并按上图进行实验。通入 O2,一段时间后,点燃 J 处酒精灯。 | 装置 K 中无水 CuSO4变①_____色 | 塑料燃烧产物中有 H2O |
装置 L 中②_____ | 塑料燃烧产物中有 CO2 |
③由上述实验可知,该塑料一定含有的元素是_____(填元素符号)。
(4)定量测定
为进一步确定组成,将 1.4g 该塑料在足量 O2 中完全燃烧,共产生了 4.4g CO2 和 1.8g H2O,依据质量守恒定律,可判断该塑料_____(填“含有”或“不含”)除上述③中结论之外的元素。