题目内容
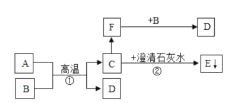
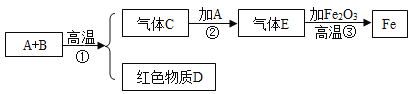
【题目】自来水厂净水过程的主要操作流程如下图:

资料:常用的絮凝剂有明矾[KAl(SO4)12H2O],消毒剂有液氯(Cl2)
回答下列问题:
(1)絮凝剂的主要作用是_____,河水通过沉淀池和过滤池的主要目的是_____。
(2)吸附池中常加入的主要物质是_____。
(3)自来水消毒过程中通常会发生化学反应,其反应的微观过程可用下图表示:
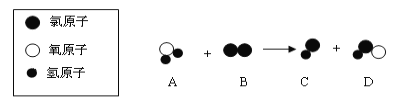
①写出上面微观图示中表示的化学方程式(友情提示:D的化学式是HClO)_____。
②A、B、C、D中属于氧化物的是_____,属于单质的是_____。
③D物质中氯元素的化合价为_____。
【答案】吸附悬浮杂质使其快速沉降 除去水中不溶性杂质 活性炭 H2O+Cl2==HCl+HClO A B +1
【解析】
(1)絮凝剂的主要作用是吸附悬浮杂质使其快速沉降,河水通过沉淀池和过滤池的主要目的是除去水中不溶性杂质。
故填:吸附悬浮杂质使其快速沉降;除去水中不溶性杂质。
(2)吸附池中常加入的主要物质是活性炭。
故填:活性炭。
(3)①据图可以看出,该反应是水和氯气反应生成盐酸和次氯酸,故填:H2O+Cl2=HCl+HClO;故填:H2O+Cl2==HCl+HClO;
②A是由两种元素组成,其中一种是氧元素的化合物,属于氧化物,B是由同种原子构成的分子,属于单质;故填:A;B;
③次氯酸中氢元素的化合价为+1,氧元素的化合价为-2,设氯元素的化合价为x,则有(+1)+x+(-2)=0,解得x=+1,故填:+1。

 名校课堂系列答案
名校课堂系列答案【题目】在学完氧气的性质后,某校课外小组同学对铁与氧气的反应进行了更深入地研究。

(1)实验1:在燃着的酒精上方抖落铁粉,观察到火星四射,如图所示。
①铁丝在空气中不能燃烧,铁粉却能在空气中燃烧,由此说明在某些工业生产中将原料粉碎的目的是_____。
②铁丝在空气中不能燃烧,在氧气中能燃烧,其燃烧的化学反应方程式为_____。
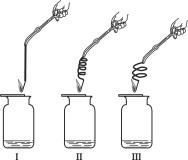
(2)实验2:用排水法收集等量的氧气作如下图所示实验,实验中所用的3根铁丝均从同1根长铁丝上截取,并且长度相同。
实验装置 | 实验现象 |
| 铁丝均燃烧,剧烈程度不同,II最剧烈,其次是III,较弱的是I。 |
①若实验中集气瓶底部不预留少量水,则可能造成的结果是______。
(3)实验3:用排水法收集等量的氧气,取不同型号的铁丝进行实验(铁丝的长度、绕成的螺旋圈数等相同)。
小资料:型号为304L、304、302铁丝,含碳量分别约为0.03%、0.08%、0.15%。
铁丝种类 | 实验现象 |
304L | 轻微火星四射 |
304 | 明显的火星四射 |
302 | 剧烈的火星四射 |
由该实验可得到的结论是:其他条件相同时,_____。