题目内容
【题目】(14分)化学是研究物质的组成、结构、性质及变化规律的科学。
(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是 (填写序号,下同),可用于人工降雨的是 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 种元素组成,其分子中氢、氧原子个数比为 。
(3)气体A和气体B接触可发生反应,生成固体C和液体D,其微观过程如下所示。
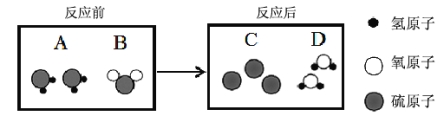
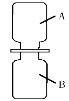
图1 图2
① 该反应过程中,属于氧化物的是 (填名称)。
② 将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比, 则充分反应后,剩余的气体是 (填化学式)。
(4)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
① 用pH试纸检测废水呈碱性的方法是 。
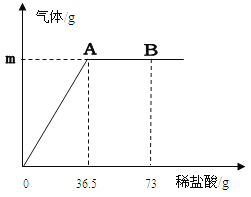
② 若某造纸厂废水中含NaOH的质量分数为l.6%,现有废硫酸9.8t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(写出计算过程)
【答案】(1)③ ② (2)3 2:1 (3)① 二氧化硫、水(多写不给分,少写1个给1分) ② SO2(4)①在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取废水滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出废水pH。②100t
【解析】
试题分析:(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是③氯化钠,可用于人工降雨的是② 干冰;(2)食醋中含有醋酸(CH3COOH),醋酸由三种元素组成,其分子中氢、氧原子个数比为2:1;(3)① 该反应过程中,属于氧化物的是有了两种元素组成且一种元素是氧元素的化合物,故二氧化硫、水;② 将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比, 则充分反应后,根据反应中的分子个数比,可知剩余的气体是二氧化硫SO2;(4)① 用pH试纸检测废水呈碱性的方法是在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取废水滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出废水pH;
②解:设可以处理的废水的质量为x 0.5分
2NaOH + H2SO4 = Na2SO4 + 2H2O 1分
80 98
1.6%x 9.8t×20% 1分
![]() 1分
1分
x=100t 1分
答:可以处理的废水的质量为 100t 0.5分

【题目】4NH3 + 5O2 = 4X + 6H2O 是硝酸工业生产中的一个化学反应,其中X的化学式是______;说明推断X化学式的依据是化学反应中必须遵循的_________________定律。
【题目】实验室区分下列各组物质的两种方法都合理的是( )
选项 | 待区分物质 | 方法一 | 方法二 |
A | 生铁和钢 | 用磁铁吸引 | 加稀盐酸 |
B | 浓硫酸和浓盐酸 | 尝味道 | 打开瓶盖闻气味 |
C | 氢氧化钠和硝酸铵 | 加入水中观察 | 观察颜色 |
D | 氧化铜和氧化铁 | 观察颜色 | 加入足量的稀盐酸 |
A. A B. B C. C D. D