题目内容
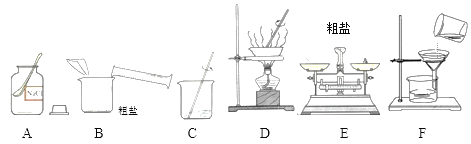
【题目】下面几种图形是常见的气体发生和收集装置,请结合题意,回答有关问题:
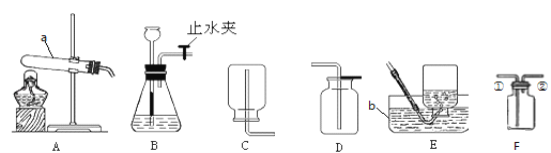
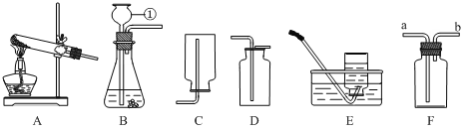
(1)图中标有a的仪器名称是___________。
(2)实验室用高锰酸钾制取氧气,需要对装置A进行的改进是______。试管口略向下倾斜的原因是_______。写出该反应的符号表达式为_________,要收集较纯净的氧气,应选择的收集装置是______(填编号,下同),如果用F装置来收集氧气则应从______端通入(填“①”或“②”),用此装置收集氧气时检验氧气收集满的方法是________。
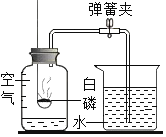
(3)已知二氧化碳气体可由大理石(固体)和稀盐酸(液体)反应,在常温下制得。该气体能溶于水,相同条件下,密度比空气大。由上述信息推知实验室制取二氧化碳可选用的装置组合是______。
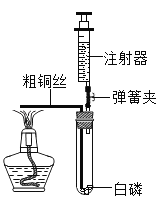
(4)某同学用如图发生装置进行过氧化氢溶液制取氧气的实验,写出过氧化氢与二氧化锰混合发生反应的符号表达式:_______。请写出该装置的一个优点是_________。实验结束后若要回收其中的二氧化锰,可采取的操作步骤是:溶解、_______、洗涤、烘干。
【答案】试管 。 在试管口加一团棉花。 防止冷凝水倒流炸裂试管 。 KMnO4 ![]() K2MnO4+MnO2+O2 E, ①, 将带火星的木条放到②导管口,若木条复燃,证明氧气已收集满。 BD H2O2
K2MnO4+MnO2+O2 E, ①, 将带火星的木条放到②导管口,若木条复燃,证明氧气已收集满。 BD H2O2![]() H2O+O2 控制产生氧气的量,得到平稳的氧气流(或者可以控制反应的速率)。 过滤。
H2O+O2 控制产生氧气的量,得到平稳的氧气流(或者可以控制反应的速率)。 过滤。
【解析】
(1)根据常见仪器的名称解答;
(2)根据实验室用高锰酸钾制取氧气的原理,实验注意事项,氧气的性质进行分析;
(3)根据反应物的状态和反应的条件选择发生装置,气体的密度和溶解性选择收集装置;
(4)根据过氧化氢溶液制取氧气的原理,实验装置的特点和过滤的原理进行分析解答。
(1)图中标有a的仪器名称是试管;
(2)实验室用高锰酸钾制取氧气,为了防止高锰酸钾粉末进入导管,试管口要放一团棉花,所以需要对装置A进行的改进是在试管口加一团棉花;试管口略向下倾斜的原因是防止水倒流炸裂试管;高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的符号表达式是KMnO4 ![]() K2MnO4+MnO2+O2;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净,要收集较纯净的氧气,应选择的收集装置是E;氧气的密度比空气的密度大,如果用F装置来收集氧气则应从①端通入;氧气具有助燃性,用此装置收集氧气时检验氧气收集满的方法是将带火星的木条放到②导管口,若木条复燃,证明氧气已收集满;
K2MnO4+MnO2+O2;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净,要收集较纯净的氧气,应选择的收集装置是E;氧气的密度比空气的密度大,如果用F装置来收集氧气则应从①端通入;氧气具有助燃性,用此装置收集氧气时检验氧气收集满的方法是将带火星的木条放到②导管口,若木条复燃,证明氧气已收集满;
(3)根据“已知二氧化碳气体可由大理石(固体)和稀盐酸(液体)反应,在常温下制得”,发生装置应选用B;根据“该气体能溶于水,相同条件下,密度比空气大”只能用向上排空气法收集,收集装置应选用D。实验室制取二氧化碳可选用的装置组合是BD;
(4)过氧化氢在二氧化锰催化作用下分解生成水和氧气,发生反应的符号表达式:H2O2![]() H2O+O2;该装置中注射器能控制液体药品滴加的量和流速,该装置的一个优点是控制产生氧气的量,得到平稳的氧气流(或者可以控制反应的速率);实验结束后若要回收其中的二氧化锰,残渣的成分是氯化钾和二氧化锰,氯化钾能溶于水,二氧化锰不溶于水,可采用:溶解、过滤、洗涤、烘干方法分离。
H2O+O2;该装置中注射器能控制液体药品滴加的量和流速,该装置的一个优点是控制产生氧气的量,得到平稳的氧气流(或者可以控制反应的速率);实验结束后若要回收其中的二氧化锰,残渣的成分是氯化钾和二氧化锰,氯化钾能溶于水,二氧化锰不溶于水,可采用:溶解、过滤、洗涤、烘干方法分离。

 阅读快车系列答案
阅读快车系列答案【题目】实验室有一瓶保管不当的试剂(如右图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小欣和小芳同学很感兴趣,决定对其成分进行探究.

(提出问题)这瓶试剂可能是什么溶液呢?
(讨论交流)根据受损标签的情况判断,这瓶试剂不可能是___________(填字母代号).
A.酸 B.碱 C.盐
(查阅资料)Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ.测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(作出猜想)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是NaHCO3,她的理由是__________________.
猜想1可能是NaOH溶液;猜想2可能是Na2CO3;猜想3可能是NaCl溶液.
(设计并实验)
a.小芳用胶头滴管吸取该溶液滴在pH试纸上.测得pH>7,则猜想__________不成立.
b.小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加_________溶液 | 有气泡产生 | 该溶液是Na2CO3溶液,相关的化学方程式是_________. |
(反想交流)请你选择与小欣不同类别的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择__________溶液(填化学式).
【题目】阅读下面科普短文。
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
生产中大量使用的臭氧通常由以下方法制得。
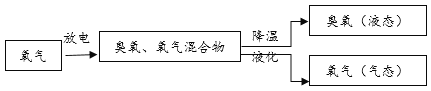
臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表1所示。
表1 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2 mg/L) | 二次污染 | 投资成本 (900 m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | < 5 min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | > 30 min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)说出氧气(O2)和臭氧(O3)的共同点______(至少一点)。
(2)臭氧处理饮用水时,利用了臭氧的______(填“物理”或“化学”)性质。
(3)臭氧转化为氧气的微观示意图如下,请在空白方框中补全相应微粒的图示。____
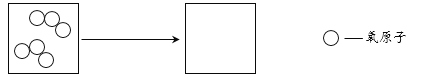
(4)依据表1信息,为了快速杀灭病毒,应选择的消毒剂是______。
(5)下列关于臭氧的说法中,正确的是______(填序号)。
A.臭氧的漂白作用比氯气强
B.由氧气制得臭氧的过程中,既有物理变化也有化学变化
C.臭氧在生产生活中有很多用途,对人类有益无害
D.臭氧稳定性差,不利于储存,其应用可能会受到限制