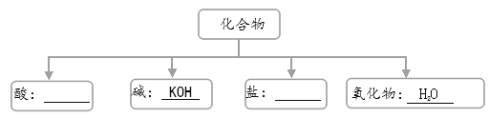
题目内容
【题目】下列元素符号书写正确的是
A. 锰Mn B. 钠NA C. 钙Cu D. 铝AL
【答案】A
【解析】元素符号书写时要注意一大二小的原则。A、正确;B、应该写为Na,错误;C、应写为Ca,错误;D、应写为Al,错误。故选A。

 名校课堂系列答案
名校课堂系列答案【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
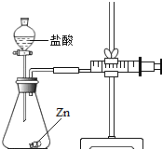
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是
.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响 (写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .