题目内容
 空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气.
空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气.(1)空气中含量最多的两种元素是
N、O
N、O
(用化学符号表示);空气是混合物而不是纯净物的依据是由氮气和氧气等多种物质组成,并保持它们各自的化学性质
由氮气和氧气等多种物质组成,并保持它们各自的化学性质
;(2)雷雨过后,空气显得特别清新,这是因为少量氧气(O2 )在一定条件下转化成了臭氧(O3),3O2
| ||
②④
②④
;①该反应属于化学变化
②该反应属于物理变化
③O2 与O3是同一种物质
④O2与O3是由同一种元素组成的不同单质
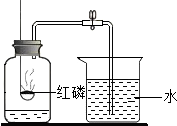
(3)课本中用如图所示装置测定空气里氧气含量,实验中发生反应的化学方程式为
4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
,反应后,判断集气瓶内无氧气剩余的事实是
| ||
燃烧匙内有剩余的红磷
燃烧匙内有剩余的红磷
.红磷燃烧过后,集气瓶内剩下的气体主要是氮气,由此推知氮气的两点化学性质是氮气不能燃烧、也不支持燃烧
氮气不能燃烧、也不支持燃烧
;(4)在空气中加热铁丝,铁丝只能发生红热现象,不能燃烧,在盛有氧气的集气瓶内能剧烈燃烧,火星四射,但都发生了化学反应,反应后生成物的化学式是
Fe3O4
Fe3O4
.你认为两种不同现象说明物质燃烧的剧烈程度与氧气的浓度有关
物质燃烧的剧烈程度与氧气的浓度有关
;(5)随着工业的发展,排放到空气中的有害气体对空气造成了污染.汽车尾气是城市主要污染之一,治理的一种办法是在汽车排气管上装催化转化器,它使CO与另一种空气污染物X(氧化物)反应生成可参与大气生态循环的无毒气体Y,反应原理为:2CO+2X
| ||
CO2
CO2
,X的相对分子质量为30
30
.分析:(1)根据空气中各成分及体积分数来计算,根据混合物的定义来回答;(2)物理变化与化学变化的本质区别;(3)通过现象推出氮气性质;(4)根据燃烧的剧烈程度来考虑;(5)解题时要分析各项叙述进行判断,还要利用有用信息和所学习的原理进行推导和计算.
解答:解:(1)空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中的主要成分是氮气和氧气,即最多的两种元素是氮元素、氧元素;混合物与纯净物的区别是否由一种物质组成;
(2)氧气和臭氧都是由氧元素组成,但化学式不一样,所以是由同种元素组成的不同单质,氧气和臭氧化学式不一样,说明由一种物质变成了另一种物质,属于化学变化;
(3)写方程式注意反应物、生成物、反应条件,在配平时要根据最小公倍数法;燃烧匙内有剩余的红磷,因此氧气消耗完全;由磷燃烧后剩余的气体主要是氮气,所以说明了氮气不能燃烧、也不支持燃的化学性质;
(4)反应后生成物都是四氧化三铁;两种不同现象说明物质燃烧的剧烈程度与氧气的浓度有关,在空气中含氧量少,所以现象也不一样.
(5)由题意可知X是一种能污染空气的氧化物,Y可参与大气生态循环的无毒气体,通过对化学方程式观察,可以初步得出X是含有氮的氧化物,Y是含有碳的无毒气体,这是因为在化学反应前后原子的种类和数目都没有改变,再利用质量守恒定律和相关信息,对上述化学方程式进一步分析可得出X是NO,Y是CO2,则X的相对分子质量=14+16=30.
故答案为:(1)N、O;由氮气和氧气等多种物质组成,并保持它们各自的化学性质;(2)②④;(3)4P+5O2
2P2O5;燃烧匙内有剩余的红磷;氮气不能燃烧、也不支持燃烧;(4)Fe3O4;物质燃烧的剧烈程度与氧气的浓度有关;(5)CO2;30.
(2)氧气和臭氧都是由氧元素组成,但化学式不一样,所以是由同种元素组成的不同单质,氧气和臭氧化学式不一样,说明由一种物质变成了另一种物质,属于化学变化;
(3)写方程式注意反应物、生成物、反应条件,在配平时要根据最小公倍数法;燃烧匙内有剩余的红磷,因此氧气消耗完全;由磷燃烧后剩余的气体主要是氮气,所以说明了氮气不能燃烧、也不支持燃的化学性质;
(4)反应后生成物都是四氧化三铁;两种不同现象说明物质燃烧的剧烈程度与氧气的浓度有关,在空气中含氧量少,所以现象也不一样.
(5)由题意可知X是一种能污染空气的氧化物,Y可参与大气生态循环的无毒气体,通过对化学方程式观察,可以初步得出X是含有氮的氧化物,Y是含有碳的无毒气体,这是因为在化学反应前后原子的种类和数目都没有改变,再利用质量守恒定律和相关信息,对上述化学方程式进一步分析可得出X是NO,Y是CO2,则X的相对分子质量=14+16=30.
故答案为:(1)N、O;由氮气和氧气等多种物质组成,并保持它们各自的化学性质;(2)②④;(3)4P+5O2
| ||
点评:熟记空气中各成分及体积分数,物理变化与化学变化的本质区别,知道燃烧的现象与什么有关.

练习册系列答案
相关题目
 空气是一种重要的自然资源.低碳经济是一种以低能耗和高效能等为主要特征,以较少的温室气体排放获得较大产出的新经济发展模式.
空气是一种重要的自然资源.低碳经济是一种以低能耗和高效能等为主要特征,以较少的温室气体排放获得较大产出的新经济发展模式.