题目内容
(7分)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数 是 。
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数)。
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数 是 。
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数)。

(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
(1)40%(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
试题分析:(1)根据氢氧化钠的化学式,可计算其中所含氧元素的质量分数为:
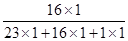 ×100%=40%
×100%=40%(2)稀释浓硫酸时,其中的溶质的质量不变。具体解题过程为:
需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3)根据题意可知:反应为硫酸与氢氧化钠反应生成硫酸钠和水。已知量为硫酸的质量,未知量为氢氧化钠溶液的溶质质量分数。解题思路:可根据化学方程式中氢氧化钠与硫酸的质量关系,先求出反应的氢氧化钠的质量。然后再根据溶质质量分数计算的方法,求出氢氧化钠溶液的溶质质量分数,即可判断具体解题过程如下:
解:(1)氢氧化钠中所含氧元素的质量分数为:
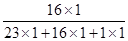 ×100%=40%
×100%=40%(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
答:(1)氢氧化钠中氧元素的质量分数为40%。
(2)需要浓硫酸的体积为27ml
(3)电解槽中NaOH溶液没有达到高浓度标准。

练习册系列答案
相关题目




 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑