题目内容
我国又迎来了一个航天高峰,继“神舟六号”宇宙飞船成功发射之后,“神舟七号”又发射在即。“神舟六号”携带了50kg的氧气,供宇航员呼吸之用,同时还有一套完整的系统用来吸收二氧化碳。有些宇宙飞船内是通过盛有氢氧化锂的过滤网来除去舱内所含的二氧化碳,反应的化学方程式如下:
2LiOH+CO2=== Li2CO3+H2O
(1)试计算1g氢氧化锂所能吸收二氧化碳的质量。
(2)若用氢氧化钾来代替氢氧化锂,试计算1g氢氧化钾所能吸收的二氧化碳的质量。
(反应的化学方程式为2KOH+CO2===K2CO2+H2O)
(3)利用(1)和(2)所得的结果,试解释为什么宇宙飞船选用氢氧化锂来吸收二氧化碳比用氢氧化钾更好?
(4)若每位宇航员每天所呼出的二氧化碳平均是502:,现有4位宇航员在进行一项为期7天的太空任务,试计算在宇宙飞船上应携带氢氧化锂的质量。(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为1.833g/L)
解析:根据化学方程式可以分别求出1g氢氧化锂和1g氢氧化钾所消耗的二氧化碳的质量;然后比较等质量的氢氧化锂和氢氧化钾所消耗二氧化碳的多少,就可以得到问题(3)的结论;最后根据问题(1)的计算结果求出问题(4)。
答案:解:(1)设1g氢氧化锂所能吸收的二氧化碳的质量为x。
2LiOH + CO2 === Li2CO3 + H2O
48 44
1g x
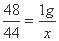 x=0.92g
x=0.92g
(2)设1g 氢氧化钾能吸收二氧化碳的质量为y
 2KOH + CO2 === K2CO2 + H2O
2KOH + CO2 === K2CO2 + H2O
 112 44
112 44
 1g y
1g y
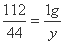 y=0.39g
y=0.39g
(3)等质量的氢氧化锂吸收的二氧化碳比氢氧化钾多,这样可以减轻宇宙
飞船的质量。
(4)设宇宙飞船上应携带的氢氧化锂的质量为z。
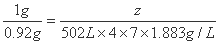 z=28005g
z=28005g
答(略)
点拨:在解答问题(4)时,不必重新代入化学方程式进行计算,以题(1)的结果为基础,计算较为简单。根据化学方程式中各物质的质量比关系,只能求出反应物或生成物的质量,而不能直接求出其体积,代入的已知量也必须是物质的质量,而不能是体积。
