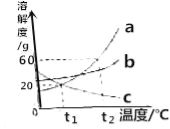
题目内容
【题目】钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,如图是某种品牌的补钙药品的部分说明书.请回答下列问题:

(1)CaCO3中各元素的质量比;
(2)CaCO3中钙元素的质量分数;
(3)若每片钙片的质量为0.5g,则钙片中钙元素的质量分数;
(4)如果按用量服用,每天摄入钙元素的质量.
【答案】(1)CaCO3中钙、碳、氧三种元素的质量比为10:3:12;(2)CaCO3中钙元素的质量分数为40%;(3)钙片中钙元素的质量分数是20%;(4)每天摄入钙元素的质量为0.2g.
【解析】(1)CaCO3中钙、碳、氧三种元素的质量比为40:12:(16×3)=10:3:12.
(2)CaCO3中钙元素的质量分数为![]() 100%=40%.
100%=40%.
(3)根据题意,每片钙片的质量为0.5g,每片含碳酸钙0.25g,则每片含钙元素0.25g×40%=0.1g,钙片中的CaCO3质量分数为![]() ×100%=20%.
×100%=20%.
(4)根据题意,每片含碳酸钙0.25g,每次一片,每天2次,则每天补充钙元素的质量为0.25g×2×40%=0.2g.
答;(1)CaCO3中钙、碳、氧三种元素的质量比为10:3:12;(2)CaCO3中钙元素的质量分数为40%;(3)钙片中钙元素的质量分数是20%;(4)每天摄入钙元素的质量为0.2g.

【题目】实验室有一瓶标签受到腐蚀的无色溶液,如图所示:
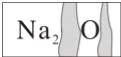
这瓶无色溶液是放在存放盐溶液的柜子里。化学兴趣小组开展探究:
【提出问题】这瓶无色溶液究竟是什么盐的溶液?
【猜想与假设】该无色溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
【初步分析】
(1)库尔班同学根据标签上的组成元素认为一定不是 溶液。
(2)艾力同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是 。
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验:
实验操作 | 实验现象 |
①取少重该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀全部溶解 |
【实验结论】
(3)该瓶无色溶液的溶质是 (填化学式),生成白色沉淀的化学反应方程式是 。
【实验反思】
(4)玉素甫同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实验操作 | 实验现象 |
(5)白燕同学经查阅资料得知:氯化钠、硫酸钠、硝酸钠溶液呈中性,碳酸钠、碳酸氢钠溶液呈碱性,提出测溶液的酸碱性来确定更简便。她采用 测量溶液的pH值 7(填>、=、<),则结论与以上同学一致。