题目内容
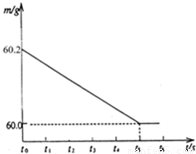
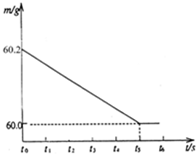 将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:
将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:
(1)反应停止后烧杯内剩余的固体物质是________.
(2)求样品中铁的质量分数.
解:(1)反应停止后烧杯内剩余的固体物质是 生铁样品中的杂质;故答案为:生铁样品中的杂质;
(2)由图示生成氢气的质量为:60.2g-60.0g=0.2g
设样品中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
 =
= 解得 x=5.6
解得 x=5.6
样品中铁的质量分数为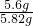 ×100%=96.2%;
×100%=96.2%;
答:样品中铁的质量分数为96.2%.
分析:(1)反应停止后烧杯内剩余的固体物质是 生铁样品中的杂质;
(2)根据图示中生成氢气的质量及反应方程式,计算样品中铁的质量,进而求样品中铁的质量分数.
点评:本题利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.
(2)由图示生成氢气的质量为:60.2g-60.0g=0.2g
设样品中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
 =
= 解得 x=5.6
解得 x=5.6样品中铁的质量分数为
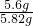 ×100%=96.2%;
×100%=96.2%;答:样品中铁的质量分数为96.2%.
分析:(1)反应停止后烧杯内剩余的固体物质是 生铁样品中的杂质;
(2)根据图示中生成氢气的质量及反应方程式,计算样品中铁的质量,进而求样品中铁的质量分数.
点评:本题利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
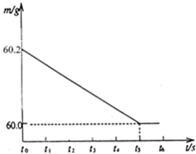 将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:
将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示: