题目内容
【题目】“酒驾”是当前热门话题之一。交巡警检查驾驶员是否饮酒的仪器里装有K2Cr2O7,K2Cr2O7中Cr元素的化合价为
A.+2价 B.+5价 C.+6价 D.+7价
【答案】C
【解析】
试题分析:根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在K2Cr2O7 中K的化合价为+1,O的化合价为+-2,故Cr元素的化合价为+6,故选C

【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
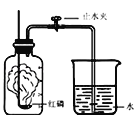
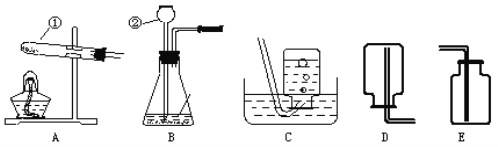
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
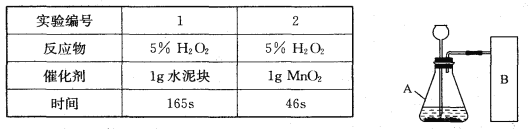
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
温度越高,过氧化氢分解的速率越大 |
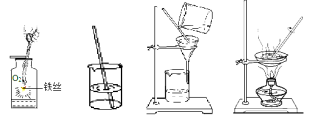
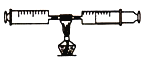
【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
(提示:铜丝在空气中加热和氧气反应生成黑色固体氧化铜)

在甲装置实验过程中,红磷燃烧集气瓶中充满白烟,一段时间后,自动熄灭了,你认为原因是____(14)___。
(3)冷却后,松开止水夹,你观察到的现象是_____(15)________
(4)从这个实验得出的结论是____________(16)__________
(5)写出红磷燃烧的化学表达式 (17)
(6)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是 (18)
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数 (19) 2l%(填“>”、“=”或“<”)。