题目内容
【题目】某化学兴趣小组用盛有AgNO3、Cu(NO3)2的混合溶液进行了如图实验
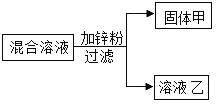
(1)若向固体甲中滴加稀硫酸有气泡产生则固体甲中一定含有哪些物质________?
(2)若溶液乙为无色溶液,请写出溶液乙中含有的溶质______(填化学式)
(3)请写出实验过程中发生反应的化学方程式____________(写出一个即可)
【答案】 Ag 、Cu 、 Zn Zn(NO3)2 合理即可
【解析】金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。盛有AgNO3、Cu(NO3)2的混合溶液中加入锌时,锌先与硝酸银反应,方程式为:Zn+2AgNO3=2Ag+Zn(NO3)2;硝酸银被反应完后,锌再与硝酸铜反应,方程式为:Zn+Cu(NO3)2==Cu+Zn(NO3)2;若向反应后的固体甲中滴加稀硫酸有气泡产生,则说明锌有剩余,固体甲中一定含有Ag 、Cu 、 Zn ;(2)若溶液乙为无色溶液,说明硝酸银、硝酸铜被反应完,溶液中只有生成的硝酸锌。锌与硫酸反应的方程式为:Zn+ H2SO4 == ZnSO4 + H2↑

练习册系列答案
相关题目