题目内容
【题目】一包固体含有镁粉、碳粉、氧化铜、氢氧化钠、氯化钾、硝酸钾中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如下所示实验:
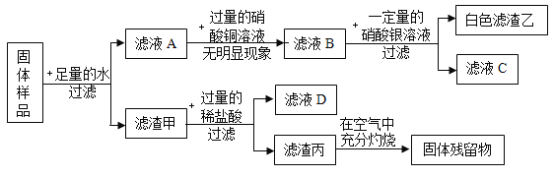
请回答下列问题:
(1)实验中生成的白色滤渣乙的化学方程式为_____。
(2)原固体中一定不含有的物质是_____;你判断的根据是_____。
(3)原固体中一定含有的物质是_____;可能含有的物质是_____。
(4)实验结束后,该兴趣小组将滤液C和滤液D都倒入到废液缸,有白色沉淀生成,上层清液E为蓝色,经检验E中不含氯离子,则E中一定含有的溶质是_____。
【答案】![]() 氢氧化钠 滤液A中加入过量的硝酸铜溶液,无明显现象 镁、氧化铜、氯化钾 硝酸钾、碳粉 KNO3、HNO3,Cu(NO3)2,Mg(NO3)2
氢氧化钠 滤液A中加入过量的硝酸铜溶液,无明显现象 镁、氧化铜、氯化钾 硝酸钾、碳粉 KNO3、HNO3,Cu(NO3)2,Mg(NO3)2
【解析】
将固体样品加足量水,过滤,可得滤液A和滤渣甲,滤液A中加过量的硝酸铜,无明显现象,说明固体样品中不含氢氧化钠,因为氢氧化钠能与硝酸铜反应生成氢氧化铜和硝酸钠,加入一定量的硝酸银溶液。产生白色沉淀,说明固体药品中含氯化钾,因为氯化钾能与硝酸银反应生成氯化银和硝酸钾;
向滤渣甲中,加入过量的稀盐酸,过滤,得到滤渣丙和滤液D,滤渣丙在空气中充分灼烧,得到固体残留物,可推出固体中含氧化铜和镁,氧化铜、镁不溶于水,加稀盐酸,氧化铜与稀盐酸反应生成氯化铜和水,待氧化铜完全反应后,镁与氯化铜反应生成氯化镁和铜,铜在空气中灼烧生成氧化铜。
综上所述,固体样品中一定含有氯化钾、镁粉、氧化铜,可能含有硝酸钾和碳粉,不含氢氧化钠。
(1)生成白色沉淀滤渣乙的反应是氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,化学方程式为:![]() ;
;
(2)通过推导可知,原固体中一定不含有的物质是氢氧化钠,判断的根据是:滤液A中加入过量的硝酸铜溶液,无明显现象;
(3)加入一定量的硝酸银溶液生成白色沉淀乙,所以混合物中一定含有氯化钾,加入过量的稀盐酸,生成的滤渣丙在空气中灼烧,有固体残留,说明有氧化铜和金属镁,氧化铜先和盐酸反应生成氯化铜,氯化铜和镁反应生成金属铜,Cu在空气中灼烧生成氧化铜,所以原固体中一定含有的物质是氯化钾、氧化铜、镁;可能含有的物质是硝酸钾、碳粉;
(4)滤液C中可能含有的溶质有Cu(NO3)2,AgNO3和KNO3,滤液D中可能含有的溶质有HCl,CuCl2和MgCl2,故生成的白色沉淀为AgCl,E中不含有氯离子,说明HCl,CuCl2,MgCl2已经和AgNO3反应完全,分别生成HNO3,Mg(NO3)2和Cu(NO3)2,AgNO3是否剩余未知,因此E中一定含有的溶质是KNO3、HNO3,Cu(NO3)2,Mg(NO3)2。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】氯化钠和碳酸钠晶体的溶解度(0~30 °C) 如下表所示:
温度 | 0°C | l0 °C | 20 °C | 30 °C |
NaCl(g) | 35.7 | 35.8 | 36.0 | 36.3 |
Na2CO3晶体(g) | 7.0 | 12.5 | 21.5 | 38.8 |
(1)根据上表分析,碳酸钠晶体的溶解度随温度____________________________
(2)将含水各100g的氯化钠与碳酸钠的饱和溶液,从30°C降至0°C时,析出氯化钠晶体的质量____________,(填“大于”“小于”或“等于”)碳酸钠晶体的质量。
(3)欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取____________方法。
(4)20°C时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是____________。
实验序号 | 水的质量(g) | 加入NaCl质量(g) | 溶液的质量(g) |
① | 10 | 2 | 12 |
② | 10 | 3 | 13 |
③ | 10 | 4 | 13.6 |
④ | 10 | 5 | 13.6 |
A ①所得溶液中溶质质量分数为20%
B ②中所得溶液是饱和溶液
C 20°C时10g水最多能溶解4gNaCl
D ③④溶液中溶质质量分数相等
【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。

A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是_____(填序号)。 (2)实验操作①中玻璃棒的作用__ | (1)实验的操作步骤是___(填序号)。 (2)实验操作④中玻璃棒的作用是___ |