题目内容
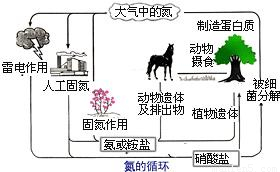
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.下图是自然界中氮的循环图,请分析此图并回答有关问题.
(1)从空气中获取氮是人类长久以来追求的目标.土壤及豆科植物能进行高效固氮,在这一过程中,氮元素由
人工固氮也在20世纪初取得了巨大突破,德国化学家哈伯发明了合成氨工艺,其主要反应的化学方程式是
(2)氨经氧化后,最终可以得到重要的化工原料硝酸,请写出工业上利用氨在催化剂(如铂、铑)存在的情况下与氧气反应的化学方程式
分析:元素存在状态有游离态和化合态,以单质形式存在的状态是游离态,以化合物的形式存在的状态是化合态;合成氨过程的化学方程式书写要根据质量守恒定律和客观事实正确书写.
解答:解:(1)空气中氮元素以氮气这一单质形式存在,是游离态,豆科植物将氮气中的氮转化成化合物中的氮,氮元素存在形式也由游离态变成了化合态.
德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气,化学方程式为:N2+3H2 2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl
2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
(2)氨在催化剂(如铂、铑)存在的情况下与氧气反应生成一氧化氮和水,方程式为4NH3+5O2
4NO+6H2O,硝酸铵不能遇碱性物质混合施用,因为铵根离子与氢氧根离子会结合成氨气,降低肥效,离子方程式为NH4++OH-=NH3+H2O
故答案为:
(1)游离(1分)、化合(1分); N2+3H2 2NH3(2分);Ca(OH)2+2NH4Cl
2NH3(2分);Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O(2分).
(2)4 NH3+5O2
4NO+6H2O(2分);NH4++OH-=NH3+H2O (2分).
德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气,化学方程式为:N2+3H2
 2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl
2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl
| ||
(2)氨在催化剂(如铂、铑)存在的情况下与氧气反应生成一氧化氮和水,方程式为4NH3+5O2
| ||
| 高温 |
故答案为:
(1)游离(1分)、化合(1分); N2+3H2
 2NH3(2分);Ca(OH)2+2NH4Cl
2NH3(2分);Ca(OH)2+2NH4Cl
| ||
(2)4 NH3+5O2
| ||
| 高温 |
点评:本题主要考查了化学方程式及离子方程式的书写,要根据题目要求和书写方程式原则正确书写.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目