题目内容
在一密闭的容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法错误的是
| 物质 | O2 | CO2 | H2O | W |
| 反应前的质量/g | 50 | 1 | 1 | 23 |
| 反应后的质量/g | 2 | 45 | 28 | x |
C..根据质量守恒定律,x的值为0 D.反应后的生成物是二氧化碳和水
AB
解析试题分析:根据质量守恒定律可知,反应前后物质质量总和不变,即50g+1g+1g+23g=2g+45g+28g+x,则x=0g,由此可知,反应物为氧气和W,生成物为二氧化碳和水;其中二氧化碳中的碳元素的质量为44g×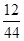 ×100%=12g,水中的氢元素的质量为27g×
×100%=12g,水中的氢元素的质量为27g×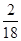 ×100%=3g,根据化学变化中元素种类和质量都不变可知,W中的碳、氧元素质量之和为12g+3g=15g,小于W的质量23g,故W中含有碳、氢、氧三种元素。
×100%=3g,根据化学变化中元素种类和质量都不变可知,W中的碳、氧元素质量之和为12g+3g=15g,小于W的质量23g,故W中含有碳、氢、氧三种元素。
A、根据以上计算可知,W含有碳、氢、氧元素,错误;
B、由于反应生成了二氧化碳和水两种化合物,故该反应不可能是置换反应,错误;
C、根据以上计算可知,x的值为0,正确;
D、反应后的生成物是二氧化碳和水,正确。故选AB
考点:质量守恒定律及其应用
点评:熟练掌握质量守恒定律,即在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;化学反应中,元素种类和质量都不变。

练习册系列答案
相关题目