题目内容
氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠.(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 |
该氢氧化钠溶液已变质 | |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 |
该氢氧化钠溶液已部分变质 |
向该溶液中加入
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
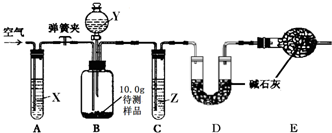
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.
实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
③若没有装置C,则会导致测定结果
【数据处理】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.(请写出计算过程)
分析:根据已有的知识进行分析,氢氧化钠易与二氧化碳反应生成碳酸钠而变质,要证明碳酸钠的存在,可以使用氢氧化钙溶液观察是否有白色沉淀生成,要证明氢氧化钠部分变质,需证明还含有氢氧化钠,将除去碳酸钠的溶液加入酚酞试液观察是否变红,要测定碳酸钠的含量,可以通过碳酸钠与酸反应生成的二氧化碳气体的质量进行,为保证实验结果的准确性,需要排除空气中成分的干扰,可以通过氢氧化钠溶液将空气中的二氧化碳除去,通过浓硫酸将水除去.
解答:解:(1)要证明碳酸钠的存在,可以使用氢氧化钙溶液观察是否有白色沉淀生成,要证明氢氧化钠部分变质,需证明还含有氢氧化钠,将除去碳酸钠的溶液加入酚酞试液观察是否变红,要除去碳酸钠可以使碳酸钠与适量的氢氧化钙反应生成碳酸钙沉淀,经过过滤除去,所以本题答案为:
适量的氢氧化钙溶液,过滤
(2)【交流讨论】①要测定碳酸钠的含量,可以通过测定反应生成的二氧化碳的质量,需要将空气中的二氧化碳通过氢氧化钠除去,然后使碳酸钠与稀硫酸反应生成二氧化碳,通过浓硫酸将水分除去,所以本题答案为:C;
②通入空气利用气流压力将生成的二氧化碳全部赶入D中被碱石灰吸收,所以本题答案为:将B中生成的二氧化碳气体全部赶入D装置中被碱石灰吸收;
③没有C装置会导致二氧化碳中混有水蒸气,导致测得的二氧化碳的质量偏大,没有E装置,会吸收空气中的二氧化碳和水,导致测得的二氧化碳的质量偏大,从而计算出的碳酸钠的质量偏大,所以本题答案为:偏大,偏大,
【数据处理】解:生成二氧化碳的质量=84.5g-83.4g=1.1g
设部分变质的氢氧化钠固体中碳酸钠的质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 1.1g
=
,x=2.65g
部分变质的氢氧化钠固体中碳酸钠的质量分数:
×100%=26.5%
答:部分变质的氢氧化钠固体中碳酸钠的质量分数为26.5%
| 实验步骤 | 实验现象 | 实验结论 |
| 足量的氯化钙溶液 | 有白色沉淀生成 | |
| 酚酞试液 | 溶液变红 |
(2)【交流讨论】①要测定碳酸钠的含量,可以通过测定反应生成的二氧化碳的质量,需要将空气中的二氧化碳通过氢氧化钠除去,然后使碳酸钠与稀硫酸反应生成二氧化碳,通过浓硫酸将水分除去,所以本题答案为:C;
②通入空气利用气流压力将生成的二氧化碳全部赶入D中被碱石灰吸收,所以本题答案为:将B中生成的二氧化碳气体全部赶入D装置中被碱石灰吸收;
③没有C装置会导致二氧化碳中混有水蒸气,导致测得的二氧化碳的质量偏大,没有E装置,会吸收空气中的二氧化碳和水,导致测得的二氧化碳的质量偏大,从而计算出的碳酸钠的质量偏大,所以本题答案为:偏大,偏大,
【数据处理】解:生成二氧化碳的质量=84.5g-83.4g=1.1g
设部分变质的氢氧化钠固体中碳酸钠的质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 1.1g
| 106 |
| x |
| 44 |
| 1.1g |
部分变质的氢氧化钠固体中碳酸钠的质量分数:
| 2.65g |
| 10.0g |
答:部分变质的氢氧化钠固体中碳酸钠的质量分数为26.5%
点评:本题考查了氢氧化钠变质的有关知识,完成此题,可以依据已有的知识进行,要求同学们在平时的学习中加强基础知识的储备,以便灵活应用.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠.
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
【拓展探究】甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入______,充分反应后,经______操作,即可除去该氢氧化钠溶液中含有的杂质.
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
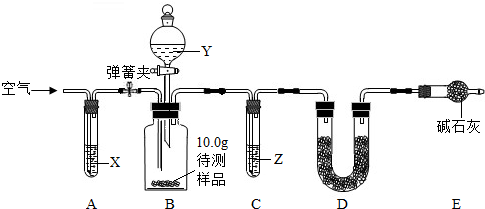
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.

实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用______(选填字母).
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是______.
③若没有装置C,则会导致测定结果______(选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果______.
【数据处理】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.(请写出计算过程)
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入______ | ______ | 该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加______ | ______ | 该氢氧化钠溶液已部分变质 |
向该溶液中加入______,充分反应后,经______操作,即可除去该氢氧化钠溶液中含有的杂质.
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.

实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用______(选填字母).
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是______.
③若没有装置C,则会导致测定结果______(选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果______.
【数据处理】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.(请写出计算过程)