题目内容
常温下,将l60g某粗盐样品(含杂质氯化镁、氯化钙和泥沙)溶解于水中,过滤得到不足3g泥沙和1000g溶液.取出500g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g.则原粗盐中氯化钠的质量分数约为( )A.73.1%
B.76.3%
C.36.6%
D.31.6%
【答案】分析:根据镁元素、钙元素的质量可以计算氯化镁、氯化钙的质量,进一步可以计算氯化镁、氯化钙中氯元素的质量,用氯元素的总质量减去氯化镁、氯化钙中氯元素的质量,就是氯化钠中氯元素的质量,又可以计算氯化钠的质量,从而求出原粗盐中氯化钠的质量分数.
解答:解:500g溶液中:
氯化镁的质量为:1.2g÷(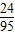 ×100%)=4.75g,
×100%)=4.75g,
则氯化镁中氯元素的质量为:4.75g-1.2g=3.55g,
氯化钙的质量为:2g÷(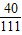 ×100%)=5.55g,
×100%)=5.55g,
氯化钙中氯元素的质量为:5.55g-2g=3.55g,
氯化钠中氯元素的质量为:42.6g-3.55g-3.55g=35.5g,
则氯化钠的质量为:35.5g÷(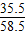 ×100%)=58.5g,
×100%)=58.5g,
则1000g溶液中氯化钠的质量为:58.5g×2=117g,
则原粗盐中氯化钠的质量分数为: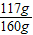 ×100%=73.1%;
×100%=73.1%;
故选:A.
点评:差量法在计算中经常遇到,要掌握差量法计算的技巧,并且能够熟练运用,对解答计算方面的题目帮助很大.
解答:解:500g溶液中:
氯化镁的质量为:1.2g÷(
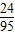 ×100%)=4.75g,
×100%)=4.75g,则氯化镁中氯元素的质量为:4.75g-1.2g=3.55g,
氯化钙的质量为:2g÷(
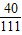 ×100%)=5.55g,
×100%)=5.55g,氯化钙中氯元素的质量为:5.55g-2g=3.55g,
氯化钠中氯元素的质量为:42.6g-3.55g-3.55g=35.5g,
则氯化钠的质量为:35.5g÷(
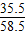 ×100%)=58.5g,
×100%)=58.5g,则1000g溶液中氯化钠的质量为:58.5g×2=117g,
则原粗盐中氯化钠的质量分数为:
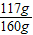 ×100%=73.1%;
×100%=73.1%;故选:A.
点评:差量法在计算中经常遇到,要掌握差量法计算的技巧,并且能够熟练运用,对解答计算方面的题目帮助很大.

练习册系列答案
相关题目
常温下,将l60g某粗盐样品(含杂质氯化镁、氯化钙和泥沙)溶解于水中,过滤得到不足3g泥沙和1000g溶液.取出500g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g.则原粗盐中氯化钠的质量分数约为( )
|
| A. | 73.1% | B. | 76.3% | C. | 36.6% | D. | 31.6% |