题目内容
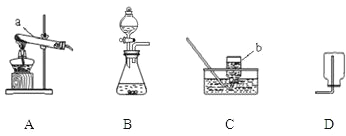
【题目】(7分)下面图示为常见气体制备、干燥和性质实验的部分仪器。根据题目要求,回答下列问题:
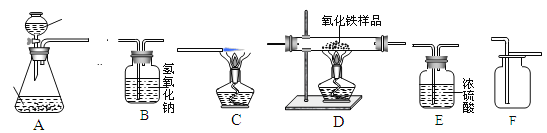
(1)欲在实验室中制备并收集干燥的氧气。
①所选仪器的连接顺序为 (填写仪器序号字母)。
②仪器A中,生成氧气的化学方程式为 。
(2)欲用含少量CO2 杂质的一氧化碳气体,测定某氧化铁样品的纯度(杂质不反应),所选仪器的连接顺序为:D→B→C。
①给装置D加热前应该先通一会儿一氧化碳气体,这样做的原因是:
。
②装置C的作用是 。
③装置B中,发生反应的化学方程式为 。
④充分反应后,若D装置减少2.4克,则样品中氧化铁的质量为 克。
⑤若通过测量反应前、后B装置的质量变化,来计算样品中氧化铁的质量,则计算结果将 。(填“偏小”“偏大” “基本不影响”其中之一)
【答案】(1)①A→E →F ②2H2O2 MnO2 2H2O+O2↑
(2)①排净玻璃管中的空气,防止加热一氧化碳和空气的混合气体而发生爆炸
② 处理尾气,防止一氧化碳污染空气 ③2NaOH+CO2 Na2CO3+H2O
④ 8 ⑤ 偏大
【解析】
试题分析:(1)①因为要制备并收集干燥的氧气,故应用浓硫酸干燥,所以所选仪器的连接顺序为:A→E →F,②生成氧气的化学方程式为:2H2O2 MnO2 2H2O+O2↑
(2)①由于一氧化碳具有可燃性,所以给装置D加热前应该先通一会儿一氧化碳气体,这样做的原因是:排净玻璃管中的空气,防止加热一氧化碳和空气的混合气体而发生爆炸
一氧化碳有毒,故②装置C的作用是:处理尾气,防止一氧化碳污染空气
③装置B中,发生反应的化学方程式为:2NaOH+CO2 Na2CO3+H2O
④根据反应发生的方程式:3CO+ Fe2O3 高温 2Fe + 3CO2,若D装置减少2.4克,D装置反应前是Fe2O3,反应后是Fe,所以减少的质量即Fe2O3中氧元素的质量,根据元素质量=物质质量×元素的质量分数,
所以Fe2O3的质量=2.4g÷48/160×100%=8g
⑤若通过测量反应前、后B装置的质量变化(即反应后生成二氧化碳的质量),再根据方程式:3CO+ Fe2O3 高温 2Fe + 3CO2中CO2与Fe2O3的质量关系,求出Fe2O3的质量,但由于装置B的右端导管口与空气接触,故空气中的二氧化碳会进入到装置B中,使二氧化碳的质量偏大,所以计算结果将偏大

【题目】空气质量引起人们的广泛关注。某天的空气质量日报如下:
污染项目 | PM2.5 | PM10 | SO2 | CO | NO2 |
污染指数 | 377 | 307 | 13 | 30 | 62 |
(1)上述污染物中,能形成酸雨的是_________________________。
(2)雾霾天环卫工人增加洒水频次,其主要目的是_______________________。